

Les hydrocarbures aliphatiques sont des composés constitués de carbone et d’hydrogène. Il peut s’agir de molécules à chaîne ouverte, linéaire ou ramifiée, saturée ou insaturée, dont la nomenclature est la suivante:
Les formules générales sont CnH2n+2 pour les paraffines, CnH2n pour les oléfines, et CnH2n-2 pour les acétyléniques.
Les hydrocarbures à petite molécule sont gazeux à la température ambiante (de C1 à C4). Plus la masse moléculaire d’un hydrocarbure est élevée et plus sa structure est complexe, plus il a tendance à devenir liquide et plus sa viscosité s’accroît (C5 à C16); et, enfin, les hydrocarbures supérieurs sont des solides à la température ambiante (au-delà de C16).
Les hydrocarbures aliphatiques d’importance industrielle dérivent principalement du pétrole, qui est lui-même un mélange complexe d’hydrocarbures. On les obtient par craquage, distillation et fractionnement du pétrole brut.
Le méthane, qui est le premier membre de la série acyclique, constitue 85% du gaz naturel, que l’on peut extraire directement de poches ou de roches magasins au voisinage des gisements de pétrole. Le pentane est produit en grande quantité par condensation fractionnée du gaz naturel.
L’industrie utilise les hydrocarbures saturés comme combustibles, comme lubrifiants et comme solvants. Après avoir subi des réactions d’alkylation, d’isomérisation et de déshydrogénation, ils constituent également des produits de base pour la synthèse des peintures, enduits protecteurs, matières plastiques, du caoutchouc synthétique, des résines, pesticides, détergents et d’une infinité de produits issus de la pétrochimie.
Les combustibles, lubrifiants et solvants sont des mélanges qui peuvent contenir un grand nombre d’hydrocarbures différents. Le gaz naturel a été longtemps distribué à l’état gazeux dans les réseaux urbains. Aujourd’hui, on en liquéfie de grandes quantités, qui sont transportées sous forme de liquide réfrigéré que l’on conserve en cet état jusqu’au moment de l’introduire tel quel ou regazéifié dans un réseau de distribution de gaz de ville. Les gaz de pétrole liquéfiés (GPL), le propane et le butane principalement, sont transportés et conservés sous pression ou comme liquides réfrigérés, et servent également d’appoint à la distribution du gaz de ville. On les utilise directement comme combustibles, souvent dans des opérations métallurgiques complexes qui exigent un combustible exempt de soufre, pour le soudage et le découpage oxypropaniques et dans des situations où une demande industrielle importante déséquilibrerait la distribution urbaine. Les installations de stockage pour ces diverses applications varient en importance dans une gamme qui va de 2 à plusieurs milliers de tonnes. On emploie aussi les GPL comme propulseurs de nombreux aérosols, et les homologues supérieurs de la série à partir de l’heptane servent aussi de carburants pour moteurs et de solvants. L’isobutane est utilisé pour ajuster la volatilité de l’essence et entre dans la composition des liquides employés pour l’étalonnage de divers instruments. Le 2,2,4-triméthylpentane est le carburant de référence standard pour la détermination de l’indice d’octane d’un carburant, et l’octane est utilisé dans les carburants antidétonants. Le nonane est un constituant non seulement des carburants, mais aussi des détergents biodégradables.
L’hexane est principalement utilisé comme solvant dans les colles, les glus et les adhésifs destinés à la production de chaussures, que ce soit en peau ou en matière plastique. Il a été employé comme solvant pour les colles servant à l’assemblage de meubles, dans les adhésifs pour papiers peints, comme solvant dans les colles pour sacs à main et valises en cuir ou en imitation cuir, dans la fabrication des imperméables, le rechappage des pneus et l’extraction des huiles végétales. En raison de la toxicité de l’hexane, il a été remplacé dans de nombreuses applications par l’heptane.
Il est impossible d’énumérer toutes les situations dans lesquelles on trouve l’hexane en milieu de travail. On peut dire simplement que, d’une manière générale, sa présence doit être suspectée dans les solvants et dégraissants volatils à base d’hydrocarbures dérivés du pétrole. L’hexane est également utilisé comme agent nettoyant dans l’industrie textile, l’industrie du meuble et celle du cuir.
Les hydrocarbures aliphatiques employés comme produits de départ des intermédiaires de synthèse peuvent être soit des composés de grande pureté, soit des mélanges relativement simples.
L’implantation de vastes installations de stockage, d’abord pour le méthane gazeux et, plus tard, pour les GPL, a été à l’origine d’explosions de grande amplitude aux effets dévastateurs qui mettent en évidence les dangers d’une fuite massive de ces substances. Le mélange inflammable de gaz et d’air peut se propager bien au-delà des distances considérées comme suffisantes dans des conditions normales de sécurité et prendre feu en présence d’une flamme à usage domestique ou d’un moteur d’automobile, même à grande distance de la zone dangereuse. Les vapeurs peuvent s’enflammer sur une vaste étendue, et la propagation de la flamme à travers le mélange peut atteindre une violence explosive. De nombreux incendies et explosions de moindre importance — néanmoins sérieux — se sont produits pendant l’utilisation de ces hydrocarbures gazeux.
Les plus grands incendies impliquant des hydrocarbures liquides se sont déclarés lorsque d’importantes quantités de liquide se sont échappées et se sont écoulées vers une partie de l’usine où il pouvait y avoir une source d’ignition ou se sont répandues sur une surface étendue et se sont évaporées rapidement. La fameuse explosion de Flixborough, au Royaume Uni, est attribuée à une fuite de cyclohexane.
Les deux premiers termes de la série, le méthane et l’éthane, sont pharmacologiquement «inertes» et appartiennent à un groupe de gaz appelés «asphyxiants simples». Ces gaz peuvent être tolérés à des concentrations élevées dans l’air inspiré sans produire d’effet général sur l’organisme. Si la concentration est suffisamment élevée pour diluer ou exclure l’oxygène normalement présent dans l’air, les effets produits seront dus à une privation d’oxygène ou à une asphyxie. Le méthane n’a pas d’odeur qui pourrait donner l’alerte. En raison de sa faible densité, il peut s’accumuler dans des zones mal ventilées en produisant une atmosphère asphyxiante. L’éthane en concentrations atmosphériques inférieures à 50 000 ppm (5%) ne produit pas d’effet général sur l’organisme.
Du point de vue pharmacologique, les hydrocarbures plus lourds que l’éthane peuvent être classés avec les anesthésiques généraux parmi les nombreux dépresseurs du système nerveux central (SNC). Les vapeurs de ces hydrocarbures sont légèrement irritantes pour les muqueuses. Le pouvoir irritant augmente en passant du pentane à l’octane. Généralement, la toxicité des alcanes tend à augmenter à mesure que la condensation en carbone augmente. De plus, les alcanes à chaîne droite sont plus toxiques que leurs isomères ramifiés.
Les hydrocarbures paraffiniques liquides sont des solvants des graisses et des irritants cutanés primaires. Un contact répété ou prolongé avec la peau la dessèche et la dégraisse, provoquant irritation et dermatite. Le contact direct des hydrocarbures liquides avec le tissu pulmonaire (aspiration) produit une pneumonie chimique, un œdème pulmonaire et une hémorragie. L’intoxication chronique par l’hexane ou par des mélanges qui en contiennent peut entraîner une polyneuropathie.
Le propane ne provoque pas de symptômes chez l’être humain lors d’une brève exposition à des concentrations de l’ordre de 10 000 ppm (1%). Une concentration de 100 000 ppm (10%) n’est pas sensiblement irritante pour les yeux, le nez ou les voies respiratoires, mais entraîne un léger étourdissement au bout de quelques minutes. Le butane provoque une somnolence, mais ne produit pas d’effet général sur l’organisme lors d’une exposition de 10 minutes à 10 000 ppm (1%).
Le pentane est le dernier des termes inférieurs de la série qui soit encore liquide à la température et à la pression ordinaires. Dans des études réalisées sur des sujets humains, une exposition de 10 minutes à 5 000 ppm (0,5%) n’a pas provoqué d’irritation des muqueuses ni d’autre symptôme.
L’heptane a causé un léger vertige chez des hommes exposés pendant 6 minutes à 1 000 ppm (0,1%) ou pendant 4 minutes à 2 000 ppm (0,2%). Une exposition de 4 minutes à 5 000 ppm (0,5%) d’heptane a eu pour effet un vertige prononcé, une inaptitude à marcher en ligne droite, de l’hilarité et une incoordination. Ces effets généraux ont été observés sans que les sujets exposés se plaignent d’irritation des muqueuses. Une exposition de 15 minutes à l’heptane à cette concentration a produit un état d’intoxication caractérisé par une hilarité incontrôlée chez certains individus et, chez d’autres, par une stupeur se prolongeant pendant 30 minutes après l’exposition. Ces symptômes ont été fréquemment intensifiés ou remarqués pour la première fois au moment de la pénétration dans une atmosphère non contaminée. Les sujets se sont également plaints de perte d’appétit, de légères nausées et d’un goût d’essence dans la bouche qui a duré plusieurs heures après l’exposition.
L’octane a provoqué chez la souris une narcose en 30 à 90 minutes à des concentrations de 6 600 à 13 700 ppm (0,66 à 1,37%). L’exposition à des concentrations inférieures à 13 700 ppm (1,37%) n’a causé ni mortalité ni convulsions.
Etant donné que, dans un mélange d’alcanes, les effets toxiques des composants s’additionnent vraisemblablement, l’Institut national de la sécurité et de la santé au travail des Etats-Unis (National Institute for Occupational Safety and Health (NIOSH)) a recommandé une valeur seuil pour la teneur totale en alcanes (C5 à C8) de 350 mg/m3 en moyenne pondérée dans le temps avec une limite supérieure de 1 800 mg/m3 sur 15 minutes. L’hexane est traité séparément en raison de sa neurotoxicité.
L’hexane, hydrocarbure aliphatique saturé à chaîne droite (ou alcane) de formule générale CnH2n+2, est un membre de la série des hydrocarbures à bas point d’ébullition (compris entre 40 et 90 °C), qui peut être obtenu à partir du pétrole par divers procédés (craquage, reformage). Ces hydrocarbures sont les constituants d’un mélange d’alcanes et de cycloalcanes à cinq à sept atomes de carbone (pentane, hexane, heptane, 2-méthylbutane, cyclopentane, 2-méthylpentane, 3-méthylpentane, cyclohexane, méthylcyclopentane). Leur distillation fractionnée permet de les séparer avec des degrés de pureté variables.
L’hexane est commercialisé sous la forme d’un mélange d’isomères à six atomes de carbone et dont le point d’ébullition va de 60 à 70 °C. Les isomères les plus courants sont le 2-méthylpentane, le 3-méthylpentane, le 2,3-diméthylbutane et le 2,2-diméthylbutane. L’expression hexane technique utilisée dans le commerce désigne un mélange dans lequel on trouve non seulement l’hexane et ses isomères, mais aussi d’autres hydrocarbures aliphatiques comportant cinq à sept atomes de carbone (pentane, heptane et leurs isomères).
On trouve des hydrocarbures à six atomes de carbone, et notamment de l’hexane, dans les dérivés du pétrole suivants: éther de pétrole, essence, naphte et ligroïne et les carburéacteurs.
L’exposition à l’hexane peut avoir des causes professionnelles ou non professionnelles. Dans le domaine professionnel, l’exposition peut se produire par l’intermédiaire de solvants pour glus, colles, adhésifs ou liquides dégraissants. La teneur en hexane de ces solvants est variable. Dans les colles à chaussures et la colle caoutchouc, elle peut représenter de 40 à 50% du solvant en poids. Les applications indiquées ici sont celles qui ont provoqué des maladies professionnelles par le passé et, dans certains cas, l’hexane a été remplacé par de l’heptane. L’exposition professionnelle à l’hexane peut également résulter de l’inhalation de vapeurs d’essence dans un dépôt de carburant ou un atelier de réparation de véhicules automobiles. Toutefois, le risque lié à ce type d’exposition professionnelle est très faible, car la concentration d’hexane dans les carburants pour automobiles est inférieure à 10% pour ne pas abaisser l’indice d’octane.
L’exposition extraprofessionnelle concerne essentiellement les enfants et les toxicomanes pratiquant l’inhalation de colle ou d’essence. La teneur en hexane varie dans ce cas entre celle admise sur le plan professionnel pour la colle et 10% ou moins pour l’essence.
L’hexane peut pénétrer dans l’organisme par deux voies: la voie respiratoire ou la voie percutanée. L’absorption est lente dans les deux cas. De fait, les mesures de concentration de l’hexane effectuées sur l’haleine exhalée dans des conditions d’équilibre montrent que la fraction d’hexane inhalé passant des poumons dans le sang est de 5,6 à 15%. La résorption percutanée est extrêmement lente.
L’hexane produit sur la peau les mêmes effets que ceux décrits précédemment pour d’autres hydrocarbures aliphatiques liquides. Il a tendance à se vaporiser en cas d’ingestion ou d’aspiration dans l’arbre trachéobronchique. La conséquence peut en être une dilution rapide de l’air alvéolaire et une chute marquée de sa teneur en oxygène, accompagnée d’une asphyxie qui entraîne des lésions cérébrales ou un arrêt cardiaque. Les lésions pulmonaires d’irritation que produit l’aspiration des homologues supérieurs (par exemple, octane, nonane, décane, etc.) et de leurs mélanges (comme le kérosène) ne s’observent pas avec l’hexane. Les effets aigus ou chroniques sont presque toujours dus à l’inhalation. La toxicité aiguë de l’hexane est trois fois supérieure à celle du pentane. Elle se manifeste lors d’une exposition aiguë à des concentrations de vapeurs d’hexane et se traduit par des étourdissements ou vertiges après une brève exposition à des concentrations d’environ 5 000 ppm pouvant aller jusqu’à des convulsions et une narcose, comme on l’observe chez l’animal à une concentration d’environ 30 000 ppm. Chez l’être humain, l’exposition pendant 10 minutes à 2 000 ppm (0,2%) ne provoque pas de symptômes; en revanche, une exposition à 880 ppm pendant 15 minutes peut provoquer une irritation des yeux et des voies aériennes supérieures.
Des effets chroniques se produisent après exposition prolongée à des doses sans effets aigus apparents, puis disparaissent lentement après que l’exposition a cessé. A la fin des années mille neuf cent soixante et au début des années mille neuf cent soixante-dix, l’attention a été attirée sur des flambées de polynévrite sensorimotrice et sensorielle parmi des travailleurs exposés à des mélanges de solvants contenant de l’hexane à des concentrations principalement comprises entre 500 et 1 000 ppm avec des pics plus élevés mais, dans certains cas, des symptômes peuvent apparaître dès 50 ppm. On a observé parfois une atrophie musculaire et une atteinte des nerfs crâniens entraînant des troubles visuels et une paresthésie faciale. Environ 50% des sujets présentaient une dénervation et une régénération des nerfs. Ils se plaignaient de fourmillements, d’engourdissement et de faiblesse dans les extrémités, essentiellement dans les membres inférieurs. On a souvent observé des trébuchements. Le réflexe achiléen était aboli, le toucher et la sensibilité à la chaleur diminués. Le temps de conduction des nerfs moteurs et sensoriels des bras et des jambes était réduit.
L’évolution de la maladie est généralement très lente. Après l’apparition des premiers symptômes, on observe souvent une détérioration du tableau clinique en raison de l’aggravation de la déficience motrice des régions initialement affectées et de son extension aux régions jusque-là saines. Cette détérioration peut se produire quelques mois après que l’exposition a cessé. L’extension se développe généralement des membres inférieurs aux membres supérieurs. Dans les cas très graves, on observe une paralysie motrice ascendante accompagnée d’une déficience fonctionnelle des muscles respiratoires. Le rétablissement peut demander de 1 à 2 ans. Il est généralement complet, mais une diminution des réflexes tendineux, en particulier du réflexe achiléen, peut persister chez un sujet apparemment en parfaite santé.
Des symptômes liés au SNC (troubles de la vue ou de la mémoire) ont été observés dans des cas graves d’intoxication par l’hexane et attribués à la dégénérescence des noyaux visuels et des voies hypothalamiques. Les lésions peuvent être permanentes.
En ce qui concerne les examens de laboratoire, les analyses biologiques les plus courantes n’indiquent pas de modifications hématologiques caractéristiques. C’est également le cas sur le plan urinaire, les analyses n’indiquant une augmentation de la créatinurie que dans les cas graves de paralysie accompagnée d’hypotrophie musculaire.
L’examen du liquide céphalo-rachidien (LCR) n’apporte pas d’indication intéressante, ni tomométrique ni qualitative, sauf dans les cas rares d’hyperprotéinorachie. Il semble que seul le système nerveux présente des anomalies caractéristiques. L’électroencéphalogramme (EEG) est généralement normal. Toutefois, dans les cas graves de cette maladie, il est possible de détecter des dysrythmies, un inconfort général ou subcortical et une irritation. Le test le plus utile est l’électromyographie (EMG). Les résultats indiquent la présence de lésions myéliniques et axonales des nerfs situés aux extrémités. La vitesse de conduction motrice (VCM) et la vitesse de conduction sensitive (VCS) sont réduites, la latence distale (LD) est modifiée et le potentiel sensitif diminué.
Le diagnostic différentiel par rapport aux autres polynévrites périphériques repose sur la symétrie de la paralysie, sur l’extrême rareté de la perte sensitive, sur l’absence d’anomalies du LCR et, surtout, sur le fait qu’il y a eu exposition à des solvants contenant de l’hexane et existence de plus d’un cas présentant des symptômes similaires sur un même lieu de travail.
Expérimentalement, l’hexane de qualité technique produit des perturbations nerveuses périphériques chez la souris à 250 ppm ou plus après 1 an d’exposition. Les études métaboliques montrent que, chez le cobaye, l’hexane et la méthylbutylcétone (MBK) ont les mêmes métabolites neurotoxiques (2-hexanediol et 2,5-hexanedione).
Les anomalies anatomiques des nerfs qui sont à l’origine des manifestations cliniques décrites ci-dessus ont été observées sur des biopsies musculaires soit chez des animaux de laboratoire, soit chez des sujets humains malades. C’est Schaumberg et Spencer qui ont reproduit expérimentalement pour la première fois en 1976 et de manière convaincante la polynévrite causée par l’hexane. Ces anomalies anatomiques consistent en une dégénérescence axonale. Cette dégénérescence axonale — et la démyélinisation de la fibre nerveuse qui en résulte — commence à la périphérie, en particulier au niveau des fibres nerveuses les plus longues, et a tendance à s’étendre vers le niveau central, sans que les neurones ne présentent de signes de dégénérescence. Ce tableau anatomique n’est pas particulier à la pathologie de l’hexane; il est commun à toute une série de neuropathies dues à des composés toxiques à usage industriel ou non industriel.
Un aspect très intéressant de la toxicologie de l’hexane réside dans la nature de ses métabolites actifs et dans ses relations avec la toxicologie d’autres hydrocarbures. Tout d’abord, il semble établi que la neuropathie en question n’est causée que par l’hexane, et non par ses isomères mentionnés ci-dessus, par le pentane ou l’heptane à l’état pur.
La figure 104.1 représente la voie métabolique de l’hexane et celle de la méthylbutylcétone (MBK) chez l’être humain. On peut voir que les deux composés ont une voie métabolique commune et que la MBK peut se former à partir de l’hexane. On a pu reproduire la neuropathie avec du 2-hexanol, du 2,5-hexanediol et de la 2,5-hexanedione. Il apparaît clairement, comme l’ont en outre montré l’observation clinique et l’expérimentation animale, que la MBK est également neurotoxique. Le plus toxique des métabolites de l’hexane est la 2,5-hexanedione. Un autre aspect important de la relation entre le métabolisme de l’hexane et sa toxicité est l’effet synergique que la méthyléthylcétone (MEK) exerce, comme on l’a montré, sur la neurotoxicité de l’hexane et de la MBK. La MEK n’est pas elle-même neurotoxique, ni pour l’animal ni pour l’être humain, mais elle provoque des lésions du système nerveux périphérique chez les animaux traités avec de l’hexane ou de la MBK, lésions qui apparaissent plus rapidement que les lésions similaires causées par ces substances seules. Il semble que ce phénomène s’explique par une interaction de la MEK avec la voie métabolique qui mène de l’hexane et de la MBK aux métabolites neurotoxiques mentionnés ci-dessus.
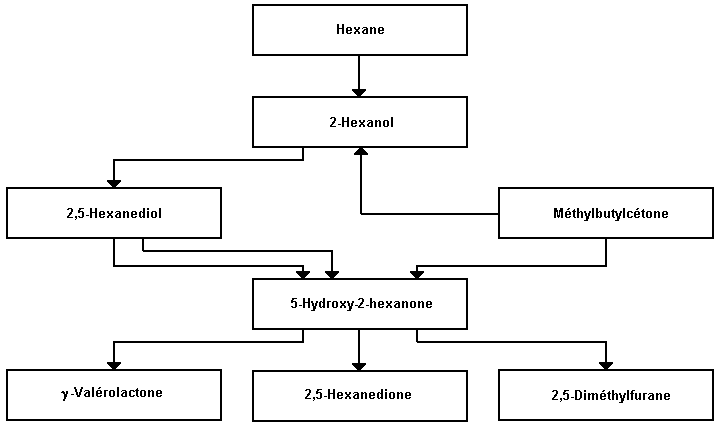
A la lumière de ce qui précède, il est clair qu’il faut éviter d’associer de l’hexane avec de la MBK ou de la MEK dans un même solvant à usage industriel. Dans la mesure du possible, il faudrait remplacer l’hexane par l’heptane.
Quant aux valeurs seuils en vigueur pour l’hexane, on a observé des modifications de l’électromyogramme chez des travailleurs exposés à des concentrations de 144 mg/ml (40 ppm), modifications qui sont absentes chez les travailleurs non exposés. Le suivi médical des travailleurs exposés repose sur la connaissance de la concentration atmosphérique de l’hexane et sur l’observation clinique et, plus précisément, l’examen neurologique. La 2,5-hexanedione urinaire est l’indicateur le plus utile de l’exposition, bien que la MBK soit un facteur de confusion. Si nécessaire, le dosage de l’hexane dans l’air expiré à la fin du poste de travail pourra confirmer l’exposition.
Les cycloparaffines sont des hydrocarbures alicycliques dont la molécule contient trois atomes de carbone ou davantage, formant une structure cyclique et qui portent chacun deux atomes d’hydrogène ou deux groupements alkyle. Tous les termes de cette série répondent à la formule générale CnH2n. Le méthylcyclohexane (C6H11CH3), par exemple, est une cycloparaffine substituée. Du point de vue de la sécurité et de la santé au travail, les plus importants d’entre eux sont le cyclohexane, le cyclopropane et le méthylcyclohexane.
Le cyclohexane intervient dans les décapants pour peintures et vernis; on l’utilise également comme solvant pour les laques et les résines, le caoutchouc synthétique ainsi que pour les graisses et les cires dans l’industrie des parfums; il sert d’intermédiaire dans la fabrication de l’acide adipique, du benzène, du chlorure de cyclohexyle, du nitrocyclohexane, du cyclohexanol et de la cyclohexanone et on l’emploie également pour la détermination de la masse moléculaire en chimie analytique. Le cyclopropane est utilisé comme anesthésique général.
Ces cycloparaffines et leurs dérivés sont des liquides inflammables, et leurs vapeurs forment des concentrations explosives dans l’air à la température ordinaire.
Ils peuvent produire des effets toxiques par inhalation et ingestion, et ils ont une action irritante et dégraissante sur la peau. Généralement, les cycloparaffines sont des anesthésiques et des dépresseurs du SNC, mais leur toxicité aiguë est faible et, du fait qu’ils sont presque complètement éliminés de l’organisme, le risque d’intoxication chronique est relativement peu important.
La toxicité aiguë du cyclohexane est très faible. Chez la souris, une exposition à 18 000 ppm (61,9 mg/l) de vapeurs de cyclohexane dans l’air provoque des tremblements au bout de 5 minutes, perturbe l’équilibre en 15 minutes, et provoque un décubitus complet en 25 minutes. Chez le lapin, les tremblements surviennent en 6 minutes, la perturbation de l’équilibre en 15 minutes, et le décubitus complet en 30 minutes. On n’a pas observé d’altérations toxiques dans les tissus de lapins après une exposition pendant 50 périodes de 6 heures à la concentration de 1,46 mg/l (434 ppm). A la concentration de 300 ppm, le composé est décelable par son odeur et par la légère irritation des muqueuses qu’il cause. Les vapeurs de cyclohexane provoquent une légère et brève anesthésie, mais plus profonde que celle induite par l’hexane.
L’expérimentation animale montre que le cyclohexane est nettement moins toxique que le benzène, son analogue aromatique à six chaînons et, en particulier, qu’il n’attaque pas le système hématopoïétique comme le fait le benzène. On pense que cette quasi-absence d’effet nocif sur les tissus hématopoïétiques est due, du moins en partie, à des différences entre le métabolisme du cyclohexane et celui du benzène. On a mis en évidence deux métabolites du cyclohexane — la cyclohexanone et le cyclohexanol —, le premier étant partiellement oxydé en acide adipique; aucun des dérivés phénoliques qui caractérisent la toxicité du benzène n’a été décelé parmi les métabolites du cyclohexane chez les animaux exposés à cette cycloparaffine; c’est pourquoi le cyclohexane a été proposé pour remplacer le benzène comme solvant.
Le méthylcyclohexane présente une toxicité similaire à celle du cyclohexane, mais plus faible. L’exposition répétée de lapins à 1 160 ppm pendant 10 semaines n’a pas produit d’effets et, à 3 330 ppm, on n’a observé qu’une légère atteinte hépatique et rénale. L’exposition prolongée à 370 ppm s’est révélée sans danger pour le singe. Aucun effet toxique dû à une exposition ou intoxication industrielles chez l’être humain par le méthylcyclohexane n’a été rapporté.
L’expérimentation animale montre que la majeure partie du composé qui pénètre dans le courant sanguin se conjugue à l’acide sulfurique et à l’acide glucuronique et qu’elle est ensuite excrétée dans l’urine sous forme de sulfo- ou de glycuroconjugués, et en particulier de glycuroconjugué du trans-4-méthylcyclohexanol.
|
Nom chimique |
Synonymes et numéro ONU |
Numéro CAS |
Formule développée |
|
Butane |
n-Butane; diéthyle; méthyléthylméthane |
|
|
|
Cyclohexane |
Hexahydrobenzène; hexaméthylène; hexanaphtène (vx) |
|
|
|
Cyclopentane |
Pentaméthylène |
|
|
|
Cyclopropane |
Triméthylène |
|
|
|
Décane |
UN2247 |
|
|
|
2,2-Diméthylbutane |
|
|
|
|
2,3-Diméthylbutane |
UN2457 |
|
|
|
2,2-Diméthylpropane |
Néopentane |
|
|
|
Ethane |
Biméthyle; diméthyle; hydrure d’éthyle; méthylméthane |
|
|
|
Heptane |
Dipropylméthane; n-heptane; hydrure d’heptyle |
|
|
|
Hexane |
n-Hexane; hydrure d’hexyle |
|
|
|
Isobutane |
2-Méthylpropane |
|
|
|
Isohexane |
|
|
|
|
Méthane |
|
|
|
|
2-Méthylbutane |
Ethyldiméthylméthane; hydrure d’isoamyle; isopentane |
|
|
|
Méthylcyclohexane |
Cyclohexylméthane; hexahydrotoluène; hexahydrure de toluène |
|
|
|
2-Méthylheptane |
|
|
|
|
3-Méthylpentane |
|
|
|
|
Nonane |
n-Nonane |
|
|
|
Octane |
n-Octane |
|
|
|
Pentane |
n-Pentane |
|
|
|
Propane |
Diméthylméthane; hydrure de propyle |
|
|
|
2,2,4-Triméthylpentane |
Isobutyltriméthylméthane; isooctane |
|
|
|
Nom chimique et numéro CAS |
Fiches internationales de sécurité chimique (ICSC) |
NIOSH |
||||
|
Exposition de courte durée |
Exposition de longue durée |
Voies d’exposition |
Symptômes |
Organes cibles et voies de pénétration |
Symptômes |
|
|
Butane |
Inhalation |
Somnolence |
Système nerveux central |
Somnolence; narcose; asphyxie; sous forme de liquide: gelures |
||
|
Cyclohexane |
Yeux; peau; voies aériennes supérieures; poumons |
Peau |
Inhalation |
Etourdissements, céphalées, nausées |
Yeux; voies respiratoires; peau, système nerveux central |
Irritation des yeux, de la peau et des voies respiratoires; somnolence; dermatite; narcose; coma |
|
Cyclopentane |
Yeux; peau; voies aériennes supérieures; poumons; système nerveux central |
Peau |
Inhalation |
Etourdissements, céphalées, nausées, perte de conscience, faiblesse |
Yeux; peau; voies respiratoires; système nerveux central |
Irritation des yeux, de la peau, du nez et de la gorge; sensation ébrieuse; étourdissements; euphorie; incoordination; nausées; vomissements; stupeur; peau sèche et crevassée |
|
Décane |
Poumons |
Peau; reins; sang |
Inhalation |
Confusion, somnolence |
||
|
Ethane |
Peau |
Inhalation |
Asphyxie |
|||
|
Heptane |
Yeux; peau; voies respiratoires; poumons; système nerveux central |
Peau |
Inhalation |
Atonie, céphalées |
Peau; voies respiratoires; système nerveux central |
Sensation ébrieuse; étourdissements; stupeur; incoordination; inappétence; nausées; dermatite; pneumonie d’aspiration (sous forme de liquide); perte de conscience |
|
Hexane |
Yeux; peau; voies respiratoires; poumons; système nerveux central; foie |
Peau; système nerveux périphérique; gènes |
Inhalation |
Etourdissements, somnolence, atonie, céphalées, respiration laborieuse, nausées, perte de conscience, faiblesse |
Peau; yeux; voies respiratoires; système nerveux central; système nerveux périphérique |
Irritation des yeux et du nez; sensation ébrieuse; nausées; céphalées; neuropathie périphérique; engourdissement des extrémités; faiblesse musculaire; dermatite; étourdissements; pneumonie d’aspiration (sous forme de liquide) |
|
2-Méthylbutane |
Yeux; peau; voies respiratoires; poumons; cœur |
Peau |
Inhalation |
Toux, étourdissements, somnolence, céphalées, essoufflement, mal de gorge, arythmie |
||
|
Méthylcyclohexane |
Poumons; système nerveux central |
Peau |
Inhalation |
Etourdissements, somnolence |
Voies respiratoires: peau; yeux; système nerveux central |
Irritation des yeux, de la peau, du nez et de la gorge; sensation ébrieuse; somnolence; chez l’animal: narcose |
|
2-Méthylheptane |
Peau |
Peau |
Rougeurs |
|||
|
Octane |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Confusion, étourdissements, somnolence, céphalées, respiration laborieuse, nausées, perte de conscience |
Peau; yeux; voies respiratoires; système nerveux central |
Irritation des yeux et du nez; somnolence; dermatite; pneumonie d’aspiration (sous forme de liquide); chez l’animal: narcose |
|
Pentane |
Poumons; système nerveux central |
Inhalation |
Etourdissements, somnolence, céphalées, nausées, perte de conscience, vomissements |
Peau; yeux; voies respiratoires; système nerveux central |
Irritation des yeux, de la peau et du nez; dermatite; pneumonie d’aspiration (sous forme de liquide); somnolence; chez l’animal: narcose |
|
|
Propane |
Peau |
Inhalation |
Asphyxie |
Système nerveux central |
Etourdissements; confusion; excitation; asphyxie; sous forme de liquide: gelures |
|
|
2,2,4-Triméthylpentane |
Yeux; peau; voies respiratoires; reins; foie |
Peau; reins; foie |
Inhalation |
Confusion, étourdissements, céphalées, nausées, vomissements |
||
|
Nom chimique et numéro CAS |
Risques physiques |
Risques chimiques |
Classification ONU/ risques subsidiaires |
|
Butane |
Gaz plus lourd que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Peut s’accumuler dans des locaux bas de plafond en appauvrissant l’atmosphère en oxygène |
La combustion dégage des gaz toxiques (oxydes de carbone) |
2.1 |
|
Cyclohexane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se former par suite d’écoulement, d’agitation, etc. |
3 |
|
|
Cyclopentane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se former par suite d’écoulement, d’agitation, etc. |
3 |
|
|
Cyclopropane |
2.1 |
||
|
Décane |
Peut réagir avec les substances oxydantes |
3 |
|
|
2,3-Diméthylbutane |
3 |
||
|
Ethane |
Gaz se mélangeant facilement à l’air, des mélanges explosifs se forment facilement |
La combustion dégage des gaz toxiques |
2.1 |
|
Heptane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. A sec, des charges électrostatiques peuvent apparaître lors de mouvement, de déversement, d’agitation, etc. |
Réagit violemment avec les oxydants énergiques. Attaque de nombreux plastiques |
3 |
|
Hexane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible |
Réagit sur les oxydants énergiques avec risque d’incendie et d’explosion |
3 |
|
Isobutane |
2.1 |
||
|
2-Méthylbutane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se produire par suite d’écoulement, d’agitation, etc. |
Risque d’explosion par chauffage. La combustion dégage des fumées âcres et des vapeurs irritantes. Réagit violemment avec les oxydants |
3 |
|
Méthylcyclohexane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se produire par suite d’écoulement, d’agitation, etc. |
Réagit violemment sur les oxydants énergiques avec risque d’incendie et d’explosion |
3 |
|
2-Méthylheptane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible |
Des vapeurs toxiques se forment par chauffage. Réagit avec les oxydants |
|
|
3-Méthylpentane |
3 |
||
|
Nonane |
3 |
||
|
Octane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se produire par suite d’écoulement, d’agitation, etc. |
Réagit sur les oxydants énergiques avec risque d’incendie et d’explosion. Attaque certains plastiques, caoutchoucs et revêtements |
3 |
|
Pentane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible |
La combustion dégage des gaz toxiques (oxydes de carbone). Réagit sur les oxydants énergiques (par exemple, peroxydes, nitrates, perchlorates) avec risque d’incendie et d’explosion. Attaque certains plastiques, caoutchoucs et revêtements |
3 |
|
Propane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Peut s’accumuler dans des locaux bas de plafond en appauvrissant l’atmosphère en oxygène |
La combustion dégage des fumées toxiques |
2.1 |
|
2,2,4-Triméthylpentane |
Vapeur plus lourde que l’air pouvant se propager au niveau du sol; inflammation à distance possible. Des charges électrostatiques peuvent se produire par suite de mouvement, d’agitation, etc. |
Le chauffage peut provoquer une violente combustion ou une explosion. Réagit avec les oxydants énergiques |
3 |
|
Nom chimique et numéro CAS |
Couleur/ aspect |
Point d’ébullition (°C) |
Point de fusion (°C) |
Masse moléculaire (g/mol) |
Solubilité dans l’eau |
Densité (eau = 1) |
Densité de vapeur (air = 1) |
Tension de vapeur (kPa) |
Limites d’explosibilité |
Point d’éclair (°C) |
Température d’auto-inflammation (°C) |
|
Butane |
Gaz incolore |
–1 à 0 |
–138 |
58,12 |
Soluble |
0,573-0,579 |
2,05 |
207 |
1,6-8,5 |
–60 cf |
287 |
|
Cyclohexane |
Liquide incolore et mobile |
81 |
6-7 |
84,16 |
Insoluble |
0,774-0,779 |
2,90 |
12,63 |
1,3-8,4 |
–20 cf |
245 |
|
Cyclopentane |
Liquide incolore |
49 |
–94 |
70,13 |
Insoluble |
0,746 |
2,42 |
53,2 |
1,1-8,7* |
–25* cf |
361 |
|
Cyclopropane |
Gaz incolore |
–33 |
–128 à –127 |
42,08 |
Soluble |
1,879 g/L |
1,45 |
516,8 |
2,4-10,4 |
497-498 |
|
|
Décane |
Liquide incolore |
172-174 |
–32 à –29 |
142,28 |
Insoluble |
0,730-0,734 |
4,90 |
0,36 |
0,8-5,4 |
44* |
209-210 |
|
2,2-Diméthylbutane |
Liquide incolore |
50 |
–100 à –99 |
86,18 |
Insoluble |
0,644-0,648 |
3,0 |
53,2 à 31 ºC |
1,2-7,0 |
–48 cf |
405 |
|
2,3-Diméthylbutane |
Liquide incolore |
58 |
–129 à –128 |
86,18 |
Insoluble |
0,662 |
3,0 |
53,2 à 39 ºC |
1,2-7,0 |
–29 cf |
405 |
|
2,2-Diméthylpropane |
Liquide ou gaz |
9-10 |
–20 à –16 |
72,15 |
Insoluble |
0,585 |
2,5 |
149,6 |
1,4-7,5 |
450 |
|
|
Ethane |
Gaz incolore |
–89 à –88 |
–183 à –172 |
30,07 |
Peu soluble |
1,04-1,05 |
3850 |
3,0-12,5 |
–135 cf |
472-530* |
|
|
Heptane |
Liquide |
98 |
–91 |
100,20 |
Insoluble |
0,684 |
3,45-3,52 |
5,32 |
1,05-6,7 |
–4 cf |
204-215 |
|
Hexane |
Liquide incolore |
69 |
–100 à –95 |
86,18 |
Insoluble |
0,660 |
2,8-3,0 |
16,5 |
1,1-7,5 |
–31 cf |
225 |
|
Isobutane |
Gaz incolore |
–12 |
–159 |
58,12 |
Peu soluble |
0,549-0,551 |
2,0 |
314 |
1,8-8,4 |
–88 cf |
460 |
|
Isohexane |
Liquide incolore |
60 |
–154 à –153 |
86,18 |
Insoluble |
0,650-0,653 |
3,00 |
23* |
1,2-7,0 |
–7* cf |
264-306* |
|
2-Méthylbutane |
Liquide incolore |
28 |
–160 |
72,15 |
Insoluble |
0,620 |
2,48 |
79,13 |
1,4-7,6 |
–51 cf |
420 |
|
Méthylcyclohexane |
Liquide incolore |
101-103 |
–127 à –126 |
98,19 |
Insoluble |
0,769 |
3,39 |
4,92 |
1,2-6,7 |
–4 cf |
250-258 |
|
2-Méthylheptane |
Liquide |
116-118 |
–109 |
114,23 |
Insoluble |
0,698 |
3,9 |
5,3 à 38 ºC |
1,0-? |
4 cf |
|
|
3-Méthylpentane |
Liquide incolore |
63-64 |
–118* |
86,18 |
Insoluble |
0,660-0,665 |
2,97 |
13,3 à 11 °C |
1,2-7,7 |
–7 cf |
278 |
|
Nonane |
Liquide incolore |
151 |
–54 à –51 |
128,26 |
Insoluble |
0,718 |
4,41 |
13,3 à 38 °C |
0,8-2,9 |
31 cf |
205 |
|
Octane |
Liquide incolore |
126 |
–57 |
114,23 |
Insoluble |
0,699-0,703 |
3,86-3,94 |
1,46 |
1,0-6,5 |
13 cf |
206 |
|
Pentane |
Liquide incolore |
36 |
–130 à –129 |
72,15 |
Peu soluble |
0,626 |
2,49 |
56,8 |
1,4-8,0 |
–40 cf |
260-309* |
|
Propane |
Gaz incolore |
–42 |
–190 à –187 |
44,10 |
Peu soluble |
0,493 |
1,55 |
870* |
2,1-9,5 |
–105* |
450 |
|
2,2,4-Triméthylpentane |
Liquide incolore et mobile |
99 |
–107 |
114,23 |
Insoluble |
0,688-0,692 |
3,93 |
5,45 |
1,1-6,0 |
–12 cf |
415-418 |