

Le présent article traite de l’ammoniac ainsi que des métaux alcalins et alcalino-terreux les plus courants: sodium, potassium, calcium, lithium et leurs composés.
L’ammoniac sert à la préparation de nombreux composés azotés. D’énormes quantités d’ammoniac sont mises en œuvre dans la production de sulfate d’ammonium et de nitrate d’ammonium, qui sont utilisés comme engrais. L’ammoniac peut aussi être utilisé pour produire de l’acide nitrique par oxydation ou encore de l’urée synthétique, ainsi que dans la production de la soude Solvay. Il sert également à préparer les solutions aqueuses destinées aux industries chimique et pharmaceutique. On l’emploie par ailleurs dans l’industrie des explosifs, en médecine et en agriculture. Dans le domaine de la réfrigération, l’ammoniac est utilisé pour abaisser les températures au-dessous du point de congélation et pour fabriquer de la glace artificielle.
L’hydroxyde d’ammonium, ou ammoniaque, est employé dans les industries suivantes: textiles, caoutchouc, pharmacie, céramiques, photographie, détergents et produits alimentaires. Il est également utilisé pour extraire de leurs minerais des métaux tels que le cuivre, le nickel et le molybdène. On l’emploie comme détachant et décolorant. Il sert d’agent nettoyant domestique et de solvant de la caséine dans l’industrie du papier. Le diphosphate d’ammonium est utilisé pour ignifuger des matières textiles et les produits à base de papier ou de bois. On le trouve dans les engrais et dans les fondants pour le brasage des métaux. Le chlorure d’ammonium est employé dans les fondants destinés à revêtir de zinc le fer-blanc, dans les explosifs de sécurité, en médecine et dans les joints de tuyauteries en fer. De plus, il intervient dans l’étamage, la teinture, la galvanoplastie et le tannage.
Par ordre d’abondance, le calcium est le cinquième parmi les éléments et le troisième parmi les métaux; il est très répandu dans la nature sous forme de carbonate de calcium (calcaire et marbre), de sulfate de calcium (gypse), de fluorure de calcium (spath fluor) et de phosphate de calcium (apatite). Les minerais de calcium sont extraits dans des carrières ou dans des mines et le métal s’obtient par électrolyse du chlorure ou du fluorure de calcium fondus. Le calcium métallique intervient dans la production d’uranium et de thorium et dans l’industrie électronique. Il est utilisé comme désoxydant dans la métallurgie du cuivre, du béryllium et de l’acier, et comme durcisseur dans l’industrie du plomb. Le calcium sert également de catalyseur dans la production industrielle des fibres polyester.
Le chlorure de calcium est un sous-produit du procédé Solvay de fabrication de carbonate de calcium à l’ammoniac. Il est utilisé comme agent antiverglas pour traiter les chaussées, comme réfrigérant et comme agent de dessiccation dans les systèmes de climatisation. Il intervient également dans la production du chlorure de baryum, du calcium métallique et de divers colorants. On l’emploie aussi dans la construction des routes pour empêcher la formation de poussières, pour accélérer les temps de prise du béton et pour empêcher la combustion spontanée du charbon dans les mines. Le nitrate de calcium est utilisé comme engrais en agriculture et comme oxydant dans la fabrication des allumettes. Il sert également dans l’industrie des explosifs et en pyrotechnie. Le sulfite de calcium est employé comme réducteur dans la production de la cellulose. Le carbure de calcium trouve des applications dans la production industrielle d’acétylène et dans la fabrication du cyanamide calcique. On l’emploie en pyrotechnie et dans les lampes à acétylène, ainsi que pour le soudage et le découpage à l’oxyacétylène.
Le terme chaux désigne les produits de calcination du calcaire, comme l’oxyde et l’hydroxyde de calcium. L’oxyde de calcium est utilisé comme matériau réfractaire, comme fondant dans la sidérurgie, comme liant dans l’industrie du bâtiment et comme matière première pour les poudres à blanchir à base de chlorure de chaux. Il est aussi employé en papeterie, dans le raffinage du sucre, en agriculture et dans le tannage du cuir. L’hydroxyde de calcium est utilisé dans le bâtiment et le génie civil pour les mortiers, les enduits et les ciments. Il sert dans le traitement des sols, la dépilation des peaux et l’ignifugeage. L’hydroxyde de calcium entre également dans la composition des lubrifiants et dans certains procédés en papeterie.
Le lithium est utilisé pour le dégazage des tubes à vide et c’est aussi un constituant des alliages d’apport pour le soudage et le brasage. On l’emploie comme réfrigérant ou échangeur thermique dans les réacteurs ou encore comme catalyseur dans la fabrication du caoutchouc synthétique et des lubrifiants. Il entre dans la composition des catalyseurs utilisés dans la production des polyoléfines et est également employé par l’industrie des métaux et des céramiques. De même, il sert à produire des verres spéciaux et des carburants pour avions et missiles. Le chlorure de lithium est utilisé dans la production d’eaux minérales et le brasage de l’aluminium. On l’emploie aussi en pyrotechnie et en médecine comme antidépresseur. Le carbonate de lithium est utilisé dans la production de glaçures pour céramiques et de couverte pour porcelaine, ainsi que pour le revêtement des électrodes de soudage à l’arc. On le trouve dans les peintures luminescentes, les vernis et les colorants. Le carbonate de lithium est également employé en médecine comme thymorégulateur et antidépresseur. L’hydrure de lithium constitue une source d’hydrogène et il est utilisé comme matériau de blindage antiradiation.
Le potassium intervient dans la synthèse de divers dérivés minéraux et entre dans la composition des engrais ainsi que dans celle des alliages sodium-potassium employés comme fluides de refroidissement dans les réacteurs nucléaires et dans les thermomètres hautes températures.
L’hydroxyde de potassium est utilisé dans la fabrication des savons liquides, pour l’absorption du dioxyde de carbone, la mercerisation du coton et la production d’autres composés du potassium. Il est employé en galvanoplastie, en lithographie et comme mordant pour le bois. Il entre également dans la composition des décapants pour peintures et vernis et dans celle des encres d’imprimerie.
Parmi les autres composés du potassium, on peut citer le bromate, le chlorate, le nitrate, le perchlorate et le permanganate de potassium. Ces composés sont utilisés en pyrotechnie, dans l’industrie alimentaire et celle des explosifs et ils servent d’agents oxydants. Le chlorate de potassium entre dans la composition des têtes d’allumettes et il sert d’agent décolorant et d’agent de teinture pour les fourrures, le coton et le bois. Il est également employé dans les matières tinctoriales et l’industrie du papier. Le chlorate de potassium intervient dans la fabrication des explosifs et des colorants ainsi qu’en pyrotechnie.
Le bromate de potassium est utilisé comme conditionnant de la pâte, comme additif alimentaire, comme agent oxydant et, en coiffure, dans les produits pour permanentes. Le nitrate de potassium entre dans la composition des feux d’artifice, des fondants, de la poudre à canon et du verre, des allumettes, du tabac et des céramiques. Il est également utilisé pour le saumurage des viandes et l’imprégnation des mèches de bougie. Il sert aussi d’engrais en agriculture et d’oxydant dans les propergols solides pour fusées. Le perchlorate de potassium est utilisé dans les explosifs, en pyrotechnie et en photographie. Il sert d’agent gonflant dans les coussins gonflables de sécurité pour automobile (airbags). Le permanganate de potassium est utilisé comme oxydant, désinfectant et décolorant en mégisserie, en métallurgie et dans le textile. On l’emploie également pour le nettoyage des métaux ainsi que comme agent de séparation et de purification dans les industries minières. De plus, le permanganate de potassium intervient comme agent de tannage dans l’industrie du cuir.
Le sodium est utilisé dans la fabrication de divers dérivés ainsi qu’en synthèse organique. Il est employé comme réducteur pour la préparation de certains métaux et comme réfrigérant dans les réacteurs nucléaires. On le trouve également dans les lampes à vapeur de sodium et dans les câbles haute tension. Le chlorate de sodium sert d’agent oxydant dans l’industrie des matières colorantes et d’agent oxydant et décolorant dans l’industrie du papier. Il est utilisé pour la teinture et l’impression des tissus, le tannage et le finissage du cuir, ainsi que pour le traitement de l’uranium. On l’emploie également comme herbicide et comme oxydant dans les carburants pour fusées. Le chlorate de sodium a encore d’autres applications dans la fabrication d’explosifs et d’allumettes, ainsi que dans l’industrie pharmaceutique.
L’hydroxyde de sodium est utilisé dans la fabrication de la soie artificielle, du coton mercerisé, du savon, du papier, des explosifs, des colorants et des produits chimiques. On l’emploie également pour le nettoyage des métaux, l’extraction électrolytique du zinc, l’étamage, le blanchissage et la décoloration. Le phosphate trisodique trouve une application dans les agents de développement photographique, dans les détergents et en papeterie. Il est utilisé pour la clarification du sucre, le détartrage des chaudières, l’adoucissement de l’eau, en blanchisserie et pour le tannage du cuir. Le phosphate trisodique sert également d’agent de traitement de l’eau et d’émulsifiant pour les fromages fondus. Le phosphate disodique est employé dans les engrais, les produits pharmaceutiques, les céramiques et les détergents. Il l’est également pour charger la soie, pour la teinture et l’impression dans l’industrie textile, ainsi que pour l’ignifugeage du bois et du papier. Le phosphate disodique sert également d’additif alimentaire et d’agent de tannage. L’hypochlorite de sodium est utilisé comme produit de blanchiment ménager ou industriel (laveries, industries papetière et textile). Il est également employé pour désinfecter le verre, les céramiques et l’eau, notamment celle des piscines. Le chlorure de sodium sert dans le travail des métaux, le traitement des peaux (salage ou saumurage), le traitement antiverglas des chaussées et la conservation des aliments. On l’emploie aussi en photographie, dans l’industrie chimique, pour la fabrication des céramiques, dans les savonneries et dans les réacteurs nucléaires.
Les sels de l’acide carbonique (H2CO3), ou carbonates, sont des produits minéraux largement répandus dans la nature. Ils sont utilisés dans le bâtiment, les industries du verre et de la céramique, en agriculture et dans l’industrie chimique. Le bicarbonate d’ammonium trouve des applications dans l’industrie des matières plastiques, des céramiques, des matières colorantes et du textile. Il est employé comme agent gonflant pour le caoutchouc expansé et comme levain dans les produits de boulangerie. Le bicarbonate d’ammonium est également utilisé comme engrais et dans les extincteurs. Le carbonate de calcium est employé principalement comme pigment pour les peintures, le caoutchouc, les matières plastiques, le papier, les cosmétiques, les allumettes et les crayons. Il trouve également des applications dans la fabrication du ciment Portland, dans les aliments, les produits de polissage, les céramiques, les encres et les insecticides. Le carbonate de sodium est largement utilisé dans la fabrication du verre, de la soude caustique, du bicarbonate de sodium, de l’aluminium, des détergents, des sels et des peintures. On l’emploie pour la désulfuration de la fonte et pour la purification du pétrole. Le bicarbonate de sodium est utilisé en confiserie, dans les produits pharmaceutiques, les boissons non alcoolisées, les industries du cuir et du caoutchouc et dans la fabrication des produits d’extinction et des eaux minérales. Le carbonate de potassium est largement utilisé dans les engrais potassés et dans l’industrie textile pour la teinture de la laine. On y recourt également pour la fabrication du verre, du savon et des produits pharmaceutiques.
Les alcalis sont des substances caustiques qui se dissolvent dans l’eau pour former une solution dont le pH est sensiblement supérieur à 7. L’ammoniac, l’hydroxyde d’ammonium, l’hydroxyde et l’oxyde de calcium, l’hydroxyde et le carbonate de potassium, l’hydroxyde, le carbonate, le peroxyde et les silicates de sodium ou encore le phosphate trisodique sont des alcalis. Le sodium et le potassium sont des métaux alcalins; ils décomposent l’eau en donnant des alcalis.
A l’état solide ou en solution liquide concentrée, les alcalis sont plus destructeurs pour les tissus biologiques que la plupart des acides. Les poussières, brouillards et aérosols d’alcalis caustiques peuvent irriter les yeux et les voies respiratoires et ulcérer la cloison nasale. Les alcalis forts se combinent avec les tissus pour former des albuminates et avec les lipides pour donner des savons. Ils gélatinisent les tissus pour former des composés solubles, susceptibles d’entraîner une atteinte profonde et douloureuse. La potasse et la soude sont les plus agressifs des alcalis. Même diluées, les solutions des alcalis les plus forts tendent à ramollir l’épiderme et à émulsifier ou à dissoudre les lipides de la peau. Au début, l’exposition à une atmosphère légèrement chargée d’alcali peut provoquer une légère irritation, mais celle-ci devient par la suite de moins en moins perceptible. Les travailleurs habitués à de telles atmosphères ne ressentent aucun effet, alors que des personnes non accoutumées sont saisies d’accès de toux, accompagnés de douleurs laryngées et d’irritation de la cavité nasale. Dans le cas des alcalis les plus forts, ce sont les projections et les éclaboussures dans les yeux, qu’il s’agisse de particules ou de solutions, qui constituent le risque majeur de ces substances.
L’hydroxyde de potassium et l’hydroxyde de sodium sont des composés très dangereux pour les yeux, aussi bien sous forme solide que sous forme liquide. En tant qu’alcalis forts, ils détruisent les tissus biologiques et provoquent des brûlures chimiques profondes. L’inhalation de poussières ou de brouillards de ces composés peut léser gravement l’appareil respiratoire tout entier et, s’ils viennent à être ingérés, les voies digestives risquent également de subir de graves lésions. Bien qu’ils ne soient ni inflammables ni oxydants, leur dissolution dans l’eau provoque un dégagement de chaleur important. Il convient donc de ne les dissoudre que dans de l’eau froide, sinon la solution risque d’entrer en ébullition en projetant des gouttes de liquide corrosif dans un vaste périmètre.
Les principaux carbonates et bicarbonates sont: le carbonate de calcium (CaCO3), la magnésite (MgCO3), le carbonate de sodium (Na2CO3), le bicarbonate de sodium (NaHCO3) et le carbonate de potassium (K2CO3). Les carbonates «neutres» (avec l’anion CO3-) et les carbonates acides ou bicarbonates (avec l’anion HCO3-) sont les principaux composés de ce groupe. Tous les bicarbonates sont hydrosolubles; parmi les carbonates ordinaires, seuls les sels des métaux alcalins sont solubles. Lorsqu’on les chauffe, les carbonates «neutres» se décomposent avant que leur point de fusion ne soit atteint. Les solutions de carbonate donnent naissance à des réactions alcalines par suite d’une hydrolyse importante. Les bicarbonates sont transformés en carbonates «neutres» par chauffage:
Les carbonates «neutres» sont décomposés par les acides forts (H2SO4, HCl) en libérant du CO2.
On trouve les carbonates de sodium sous les formes suivantes: carbonate de sodium anhydre (Na2CO3); carbonate de sodium cristallisé — bicarbonate de sodium (NaHCO3); et carbonate de sodium décahydraté (Na2CO3 · 10 H2O).
Les carbonates alcalins peuvent provoquer une forte irritation de la peau, des conjonctives et des voies aériennes supérieures au cours de diverses opérations industrielles (manutention, stockage et transformation). Les travailleurs qui chargent et déchargent des carbonates ensachés peuvent présenter des foyers de nécrose cutanée de la taille d’une cerise, sur les bras et les épaules. On observe parfois des ulcérations assez profondes, une fois que les croûtes brun-noir sont tombées. Un contact prolongé avec des solutions de carbonate de sodium peut provoquer un eczéma, une dermatite et des ulcérations.
Le calcium et ses composés. Le calcium est un constituant essentiel bien connu du corps humain, et son métabolisme, seul ou en association avec celui du phosphore, a fait l’objet d’études approfondies, en particulier concernant le système musculo-squelettique et les membranes cellulaires. Il peut y avoir perte de calcium dans un certain nombre de circonstances, notamment en cas d’immobilisation, de troubles disgestifs, de température basse, de vols spatiaux en apesanteur, etc. L’absorption de calcium dans l’environnement professionnel par inhalation de composés du calcium sous forme de poussières n’augmente pas sensiblement l’apport journalier de calcium par les légumes et autres aliments (généralement 0,5 g). Le calcium métallique réagit en présence d’eau ou d’humidité pour donner un alcali et peut provoquer des brûlures oculaires et cutanées. Exposé à l’air, il peut présenter un risque d’explosion.
Le carbure de calcium est fortement irritant en raison de la formation d’hydroxyde de calcium par réaction avec l’humidité de l’air ou la sueur. Par contact avec la peau, le carbure sec peut provoquer une dermatite. Le contact avec la peau humide et les muqueuses entraîne des ulcérations qui laissent des cicatrices. Le carbure de calcium est particulièrement dangereux pour les yeux. On observe souvent un type particulier de mélanodermie se manifestant par une forte hyperpigmentation et de nombreuses télangiectasies. Les brûlures par le carbure de calcium chaud sont fréquentes. Les lésions tissulaires ont généralement une profondeur de 1 à 5 mm; ces brûlures évoluent très lentement, elles sont difficiles à traiter et exigent souvent une excision. Les travailleurs blessés ne peuvent reprendre le travail qu’après cicatrisation complète. Les personnes exposées au carbure de calcium souffrent fréquemment de chéilite caractérisée par une sécheresse, un gonflement et une hyperémie des lèvres, une intense desquamation, et des fissures radiales profondes; on peut observer, aux commissures des lèvres, des lésions érosives ayant tendance à suppurer. Les travailleurs ayant un long passé professionnel souffrent souvent de lésions unguéales — c’est-à-dire d’onychie et de paronychie professionnelles. Les lésions oculaires associées à une hyperémie prononcée des lèvres et de la conjonctive, souvent accompagnées de sécrétions mucopurulentes, sont également fréquentes. Dans les cas graves, la sensibilité de la conjonctive et celle de la cornée sont fortement réduites. Bien que la kératite et la kératoconjonctivite présentent une phase initiale asymptomatique, elles peuvent dégénérer plus tard en opacité cornéenne.
Lors de la production du carbure de calcium, la présence d’impuretés peut constituer un risque supplémentaire. Le carbure de calcium contaminé par du phosphate ou de l’arséniate de calcium peut, s’il est humide, donner naissance à de la phosphine ou de l’arsine, tous deux extrêmement toxiques. Le carbure de calcium lui-même, lorsqu’il est exposé à de l’air humide, libère de l’acétylène, qui se comporte comme un anesthésique et un asphyxiant modéré et présente un risque considérable d’incendie et d’explosion.
Le chlorure de calcium a une puissante action irritante sur la peau et les muqueuses, et on a rapporté, parmi des travailleurs affectés au conditionnement du chlorure de calcium sec, des cas d’irritation accompagnée d’un érythème et d’une desquamation de la face, avec larmoiement, écoulement oculaire, sensation de brûlure et douleur au niveau des fosses nasales, parfois joints à des saignements du nez et à des chatouillements dans la gorge. Des cas de perforation de la cloison nasale ont également été observés.
Le nitrate de calcium a une action irritante et cautérisante sur la peau et les muqueuses. C’est un oxydant puissant qui présente un risque important d’incendie et d’explosion.
On ne connaît pas de cas d’intoxication professionnelle au sulfite de calcium. L’ingestion accidentelle de quelques grammes peut provoquer des vomissements répétés, une violente diarrhée, des troubles circulatoires et une méthémoglobinémie.
L’ammoniac est présent en petites quantités dans l’air, l’eau, la terre et, en particulier, dans les matières organiques en décomposition. C’est un produit normal du métabolisme humain, animal et végétal. Un effort musculaire et une excitation du système nerveux entraînent la formation d’une quantité accrue d’ammoniac, dont l’accumulation dans les tissus pourrait entraîner une intoxication. La formation endogène d’ammoniac augmente également au cours de nombreuses maladies. Lors des processus vitaux, il se combine dans l’organisme et il en est excrété, principalement dans les urines et la sueur, sous la forme de sulfate d’ammonium et d’urée. L’ammoniac joue également un rôle primordial dans le cycle de l’azote chez les végétaux.
L’ammoniac est très réactif, il s’oxyde facilement et donne lieu à des réactions de substitution ou d’addition (d’atomes d’hydrogène). Il brûle dans l’air ou dans l’oxygène en donnant de l’azote. Comme exemple de réaction de substitution, on peut citer la formation d’amidures de métaux alcalins ou alcalino-terreux. Par addition, il forme des ammoniacates (par exemple, CaCl2·8NH3, 2AgCl, 3NH3) et d’autres composés. Lorsque l’ammoniac se dissout dans l’eau, il forme de l’hydroxyde d’ammonium (NH4OH), qui est une base faible et se dissocie comme suit:
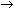 NH4+ + OH-
NH4+ + OH-Le radical NH4+ n’existe pas à l’état libre, étant donné qu’il se décompose en ammoniac et hydrogène lorsqu’on tente de l’isoler.
L’intoxication par l’ammoniac peut se produire principalement au cours des opérations de fabrication de l’ammoniac et de l’acide nitrique, du nitrate et du sulfate d’ammonium, d’engrais liquides (ammoniacates), de l’urée et du carbonate de sodium, dans le domaine de la réfrigération, dans les usines de fabrication de glace artificielle, les ateliers d’impression sur coton, lors d’opérations telles que la teinture des fibres, la galvanoplastie, la synthèse organique, le traitement thermique des métaux (nitruration), dans les laboratoires chimiques et lors d’un certain nombre d’autres opérations. Il se forme et est émis dans l’air pendant le traitement du guano et au cours de la purification des déchets; on le trouve dans les raffineries de sucre et les tanneries, et il est présent dans l’acétylène brut.
L’intoxication professionnelle est généralement aiguë, tandis que l’intoxication chronique, bien que possible, est moins courante. L’effet irritant de l’ammoniac est ressenti particulièrement au niveau des voies aériennes supérieures et, à concentration élevée, il affecte le système nerveux central, causant des spasmes. L’irritation des voies aériennes supérieures se produit aux concentrations supérieures à 100 mg/m3, la concentration maximale admissible en une heure étant comprise entre 210 et 350 mg/m3. Les projections dans les yeux de solutions aqueuses d’ammoniac sont particulièrement dangereuses. La pénétration rapide de l’ammoniac dans le tissu oculaire peut aboutir à une perforation de la cornée et à la destruction du globe oculaire. Des risques particuliers pour la santé existent dans chaque secteur d’une usine de fabrication d’ammoniac. Là où les gaz sont préparés, convertis (oxydation de CO en CO2), comprimés et purifiés, le principal problème est celui du dégagement de monoxyde de carbone et de sulfure d’hydrogène. Des quantités importantes d’ammoniac peuvent s’échapper au cours de sa synthèse. L’ammoniac présent dans l’atmosphère peut alors atteindre les limites d’explosivité.
Les chlorates et perchlorates sont les sels respectifs de l’acide chlorique (HClO3) et de l’acide perchlorique (HClO4). Ils activent fortement la combustion et leur principal danger découle de cette propriété. Les sels de potassium et de sodium sont caractéristiques du groupe et sont les plus couramment utilisés dans l’industrie.
Risques d’incendie et d’explosion. Les chlorates sont des oxydants énergiques et le danger principal est celui d’un incendie ou d’une explosion. Ils ne sont pas eux-mêmes explosifs, mais forment des mélanges inflammables ou explosifs avec les matières organiques, le soufre, les sulfures, les poudres métalliques et les composés de l’ammonium. Les vêtements, le cuir, le bois et le papier imprégnés de chlorates deviennent extrêmement inflammables.
Les perchlorates sont aussi des oxydants énergiques. Les perchlorates de métaux lourds sont explosifs.
Risques pour la santé. Les chlorates sont toxiques s’ils sont ingérés ou inhalés sous forme de poussières qui peuvent provoquer des maux de gorge, de la toux, une méthémoglobinémie avec cynose cutanée, des étourdissements et de la faiblesse ainsi qu’une anémie. En cas d’absorption de grandes quantités de chlorate de sodium, on peut observer une élévation du taux sérique de sodium.
Les perchlorates peuvent pénétrer dans l’organisme soit par inhalation, sous forme de poussières, soit par ingestion. Ils sont irritants pour la peau, les yeux et les muqueuses. Ils provoquent une anémie hémolytique avec méthémoglobinémie, l’apparition de corps de Heinz dans les globules rouges et des lésions hépatiques et rénales.
|
Nom chimique |
Synonymes et numéro ONU |
Numéro CAS |
Formule chimique |
|
Ammoniac |
Ammoniac anhydre |
|
NH3 |
|
Ammonium, bicarbonate d’ |
Carbonate d’ammonium; hydrogénocarbonate d’ammonium; acide carbonique, sel de monoammonium; carbonate de monoammonium |
|
(NH4)CO3H |
|
Ammonium, chlorure d’ |
Salmiac (vx) |
|
NH4Cl |
|
Ammonium, fluorure d’ |
Fluorure d’ammonium |
|
NH4F |
|
Ammonium, hydroxyde d’ |
UN2073 |
|
NH4OH |
|
Ammonium, nitrate d’ |
Acide nitrique, sel d’ammonium |
|
NH4NO3 |
|
Calcium |
UN1401 |
|
Ca |
|
Calcium, bromate de |
|
Ca(BrO3)2 |
|
|
Calcium, carbonate de |
Calcaire; marbre; pierre de Portland |
|
CaCO3 |
|
Calcium, carbure de |
Acétylènogène (vx); acétylure de calcium; dicarbure de calcium |
|
CaC2 |
|
Calcium, chlorate de |
Acide chlorique, sel de calcium |
|
Ca(ClO3)2 |
|
Calcium, chlorure de |
|
CaCl2 |
|
|
Calcium, hydroxyde de |
Dihydroxyde de calcium; hydrate de calcium; chaux éteinte; chaux hydratée |
|
Ca(OH)2 |
|
Calcium, hydrure de |
|
CaH2 |
|
|
Calcium, nitrate de |
Dinitrate de calcium; nitrate de calcium; salpêtre terreux |
|
Ca(NO3)2 |
|
Calcium, nitrite de |
|
Ca(NO2)2 |
|
|
Calcium, oxyde de |
Chaux brûlée; chaux; chaux vive |
|
CaO |
|
Carbonique, acide (sel de calcium) |
Carbonate de calcium |
|
CaCO3 |
|
Diammonium, phosphate de |
|
(NH4)2HPO4 |
|
|
Hydroxylamine |
Oxyammoniaque |
|
H3NO |
|
Hydroxylamine, chlorhydrate d’ |
Chlorure d’hydroxylammonium |
|
ClH4NO |
|
Hydroxylamine, sulfate d’ |
|
H8N2O6S |
|
|
Lithium |
UN1415 |
|
Li |
|
Lithium, carbonate de |
Acide carbonique, sel de dilithium; acide carbonique, sel de lithium; carbonate de dilithium |
|
Li2CO3 |
|
Lithium, chlorure de |
|
LiCl |
|
|
Lithium, hydroxyde de |
UN2679 |
|
LiOH |
|
Lithium, hydroxyde de, monohydraté |
|
LiOHH2O |
|
|
Lithium, hydrure de |
UN1414 |
|
LiH |
|
Perchlorique, acide (sel de potassium) |
Perchlorate de potassium |
|
KclO4 |
|
Perchlorique, acide (sel de sodium) |
Perchlorate de sodium |
|
NaClO4 |
|
Potassium |
UN1420 |
|
K |
|
Potassium, bromate de |
UN1484 |
|
KbrO3 |
|
Potassium, bromure de |
Sel de bromure de potassium |
|
KBr |
|
Potassium, carbonate de |
Acide carbonique, sel de dipotassium; cendre perlée; perlasse; potasse; potasse carbonatée |
|
K2CO3 |
|
Potassium, chlorate de |
UN1485 |
|
KclO3 |
|
Potassium, fluorure de |
UN1812 |
|
KF |
|
Potassium, hydroxyde de |
Potasse caustique; hydrate de potassium |
|
KOH |
|
Potassium, iodate de |
Acide iodique, sel de potassium |
|
KIO3 |
|
Potassium, iodure de |
|
KI |
|
|
Potassium, nitrate de |
Acide nitrique, sel de potassium; salpêtre |
|
KNO3 |
|
Potassium, nitrite de |
Acide nitreux, sel de potassium |
|
KNO2 |
|
Potassium, oxyde de |
|
K2O |
|
|
Potassium, périodate de |
|
KIO4 |
|
|
Sodium |
UN1428 |
|
Na |
|
Sodium, bicarbonate de |
Levure chimique; carbonate de monosodium; carbonate acide de sodium; hydrogénocarbonate de sodium |
|
NaHCO3 |
|
Sodium, bromate de |
Acide bromique, sel de sodium |
|
NaBrO3 |
|
Sodium, carbonate de |
Carbonate de disodium; soude calcinée; soude Solvay; soude à l’ammoniac; trona |
|
Na2CO3 |
|
Sodium, chlorate de |
Acide chlorique, sel de sodium; chlorate de soude |
|
NaclO3 |
|
Sodium, chlorite de |
UN1496 |
|
NaclO2 |
|
Sodium, chlorure de |
Sel de cuisine; sel marin; sel gemme |
|
NaCl |
|
Sodium, éthylate de |
Ethanol, sel de sodium; alcoolate de sodium; éthanolate de sodium |
|
NaOC2H5 |
|
Sodium, hydroxyde de |
Soude caustique; hydrate de sodium |
|
NaOH |
|
Sodium, hypochlorite de |
Acide hypochloreux, sel de sodium; |
|
NaOCl |
|
Sodium, iodure de |
|
NaI |
|
|
Sodium, méthylate de |
Méthoxyde de sodium; méthanol, sel de sodium |
|
NaOCH3 |
|
Sodium, monohydrogénophosphate de |
Hydrogénophosphate de disodium; orthophosphate de disodium; phosphate de disodium; acide phosphorique, sel de disodium; hydrogénophosphate de sodium |
|
Na2HPO4 |
|
Sodium, nitrate de |
Acide nitrique, sel de sodium; azotate de sodium; salpêtre du Chili; nitrate de soude |
|
NaNO3 |
|
Sodium, nitrite de |
Acide nitreux, sel de sodium |
|
NaNO2 |
|
Sodium, peroxyde de |
Dioxyde de disodium; peroxyde de disodium; dioxyde de sodium |
|
Na2O2 |
|
Sodium, phosphate de |
Phosphate de sodium tribasique; orthophosphate de trisodium; |
|
Na3PO4 |
|
Sodium, tripolyphosphate de |
Triphosphate de pentasodium; acide triphosphorique, sel de pentasodium; tripolyphosphate de pentasodium; phosphate de sodium |
|
Na5P3O10 |
|
Tétraméthylammonium, chlorure de |
|
N(CH3)4Cl |
|
Nom chimique et numéro CAS |
Fiches internationales de sécurité chimiques (ICSC) |
NIOSH |
||||
|
Exposition de courte durée |
Exposition de longue durée |
Voies d’exposition |
Symptômes |
Organes cibles et voies de pénétration |
Symptômes |
|
|
Ammoniac |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse; les symptômes peuvent être retardés |
Yeux; peau; voies respiratoires |
Irritation des yeux, du nez et de la gorge; dyspnée; bronchospasmes; douleurs thoraciques; œdème pulmonaire; expectorations spumeuses rosâtres; brûlures cutanées, vésiculation; sous forme de liquide: gelures |
|
|
Ammonium, chlorure d’ |
Yeux; peau; voies respiratoires |
Inhalation |
Toux |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des voies respiratoires; toux; dyspnée; sensibilisation pulmonaire |
|
|
Calcium, carbure de |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Toux, respiration laborieuse, essoufflement, mal de gorge |
|||
|
Calcium, hydroxyde de |
Peau; voies respiratoires; yeux |
Peau |
Inhalation |
Sensation de brûlure, toux |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des voies aériennes supérieures; brûlures oculaires et cutanées; vésiculation; toux, bronchite, pneumopathie |
|
Calcium, oxyde de |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Sensation de brûlure, toux, essoufflement |
Voies respiratoires; peau; yeux |
Irritation des yeux, de la peau et des voies aériennes supérieures; ulcérations; perforation de la cloison nasale; pneumopathie; dermatite |
|
Carbonique, acide |
Yeux; voies respiratoires |
Inhalation |
Toux |
|||
|
Lithium |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, essoufflement |
|||
|
Lithium, carbonate de |
Yeux; peau; voies respiratoires; système nerveux central; système cardio-vasculaire; voies digestives |
Peau; système nerveux central; système cardio-vasculaire; estomac; reins, gènes |
Inhalation |
Sensation de brûlure, toux, mal de gorge |
||
|
Lithium, chlorure de |
Yeux; peau; voies respiratoires |
Peau; système nerveux central; reins; gènes |
Inhalation |
Sensation de brûlure, toux, mal de gorge |
||
|
Lithium, hydroxyde de |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, essoufflement |
||||
|
Lithium, hydroxyde de, monohydraté |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, essoufflement |
||||
|
Lithium, hydrure de |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Toux, nausées, vomissements, tremblements, fasciculation, confusion, vision trouble, respiration laborieuse; les symptômes peuvent être retardés |
Yeux; peau; voies respiratoires; système nerveux central |
Irritation des yeux et de la peau; brûlures oculaires et cutanées; brûlures de l’œsophage (si ingestion); nausées; fasciculation; confusion mentale; vision trouble |
|
|
Perchlorique, acide |
Yeux; peau; voies respiratoires |
Sang |
Inhalation |
Toux, mal de gorge |
||
|
Potassium, chlorate de |
Muqueuses; voies aériennes supérieures; sang; foie; reins; système nerveux central |
Peau |
Inhalation |
Cyanose labiale ou unguéale, anémie, hémorragie hémolytique, nausées, essoufflement, perte de conscience, vomissements; les symptômes peuvent être retardés |
||
|
Potassium, hydroxyde de |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des voies respiratoires; toux, éternuements; brûlures oculaires et cutanées; vomissements; diarrhée |
|
Potassium, nitrite de |
Yeux; peau; voies respiratoires; sang; système cardio-vasculaire |
Inhalation |
Cyanose labiale, unguéale ou cutanée, toux, étourdissements, céphalées, respiration laborieuse, mal de gorge, perte de conscience |
|||
|
Potassium, oxyde de |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, essoufflement |
|||
|
Sodium, chlorate de |
Yeux; peau; voies respiratoires; sang; reins |
Peau |
Inhalation |
Toux, mal de gorge |
||
|
Sodium, hydroxyde de |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des muqueuses; pneumopathie; brûlures oculaires et cutanées; alopécie temporaire |
|
Sodium, méthylate de |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse |
|||
|
Sodium, nitrite de |
Yeux; peau; voies respiratoires; sang; système nerveux central; reins |
Inhalation |
Cyanose labiale, unguéale ou cutanée, toux, étourdissements, céphalées, respiration laborieuse, mal de gorge, perte de conscience |
|||
|
Nom chimique et numéro CAS |
Risques physiques |
Risques chimiques |
Classification ONU/ risques subsidiaires |
|
Ammoniac |
Gaz plus léger que l’air. Difficile à enflammer. Les déversements de liquides sont à très basse température et s’évaporent rapidement |
Des composés sensibles aux chocs se forment avec les oxydes de mercure, d’argent et d’or. Base forte qui réagit violemment avec les acides et qui corrode l’aluminium et le zinc. Réagit violemment avec les oxydants énergiques, les halogènes et les interhalogènes. Attaque le cuivre, l’aluminium, le zinc et leurs alliages. Se dissout dans l’eau en dégageant de la chaleur |
2.3/8 |
|
Ammonium, chlorure d’ |
Se décompose par chauffage ou en brûlant, avec dégagement de vapeurs toxiques et irritantes (oxydes d’azote, ammoniac, chlorure d’hydrogène). Acide faible en solution aqueuse. Réagit violemment sur le nitrate d’ammonium et le chlorate de potassium avec risque d’incendie et d’explosion. Réagit avec les acides très concentrés pour former du chlorure d’hydrogène et avec les bases fortes pour former de l’ammoniac. Réagit avec les sels d’argent pour former des composés sensibles aux chocs mécaniques. Attaque le cuivre et ses composés |
||
|
Ammonium, fluorure d’ |
6.1 |
||
|
Ammonium, hydroxyde d’ |
8 |
||
|
Ammonium, nitrate d’ |
La chaleur peut provoquer une combustion violente ou une explosion. Se décompose par chauffage ou en brûlant, avec dégagement de vapeurs toxiques (oxydes d’azote). Oxydant énergique qui réagit avec les matières combustibles et réductrices |
5.1 |
|
|
Calcium |
4.3 |
||
|
Calcium, carbure de |
Se décompose violemment au contact de l’eau, avec dégagement d’acétylène, d’où risque d’incendie et d’explosion |
4.3 |
|
|
Calcium, chlorate de |
5.1 |
||
|
Calcium, hydroxyde de |
Se décompose par chauffage pour donner de l’oxyde de calcium. Base moyennement forte |
8 |
|
|
Calcium, hydrure de |
4.3 |
||
|
Calcium, nitrate de |
5.1 |
||
|
Calcium, oxyde de |
Base moyennement forte en solution dans l’eau qui réagit violemment avec les acides forts, l’eau, le chlore et le trifluorure de bore. Réagit sur l’eau, avec dégagement de chaleur suffisant pour enflammer les matériaux combustibles |
8 |
|
|
Carbonique, acide (sel de calcium) |
Se décompose par chauffage pour donner du dioxyde de carbone. Réagit sur les acides, avec dégagement de dioxyde de carbone |
||
|
Lithium |
La chaleur peut provoquer une combustion violente ou une explosion. Peut s’enflammer spontanément au contact de l’air. Réagit violemment sur les oxydants énergiques, les acides et de nombreux composés (hydrocarbones, halogènes, halons) avec risque d’incendie et d’explosion. Réagit violemment avec l’eau pour donner de l’hydrogène très inflammable et des vapeurs corrosives d’hydroxyde de lithium |
4.3 |
|
|
Lithium, carbonate de |
Se décompose par chauffage pour donner du monoxyde de carbone et du dioxyde de carbone. Base forte en solution dans l’eau qui réagit violemment avec les acides et qui corrode l’aluminium et le zinc. Réagit violemment avec le fluor. Attaque l’aluminium et le zinc |
||
|
Lithium, chlorure de |
La solution aqueuse corrode les métaux |
||
|
Lithium, hydroxyde de |
Base forte en solution dans l’eau qui réagit violemment avec les acides et qui corrode l’aluminium et le zinc |
||
|
Lithium, hydroxyde de, monohydraté |
Base forte en solution dans l’eau qui réagit violemment avec les acides et corrode l’aluminium et le zinc |
8 |
|
|
Lithium, hydrure de |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Peut s’enflammer spontanément au contact de l’air. Se décompose par chauffage vers 500 °C ou encore en présence d’humidité ou d’acides, en produisant un gaz inflammable. Réagit violemment avec les oxydants énergiques. Réagit avec l’eau pour donner de l’hydroxyde de lithium (très caustique) et de l’hydrogène inflammable. Réagit avec les alcools inférieurs, les acides carboxyliques, les chlorures et l’ammoniac à 400 °C pour donner de l’hydrogène. La poudre d’hydrure de lithium et l’oxygène liquide sont des explosifs détonants |
4.3 |
|
Perchlorique, acide (sel de potassium) |
Se décompose par chauffage, avec dégagement de vapeurs toxiques (chlore, oxydes de chlore). Réagit violemment avec les poudres métalliques, les matières combustibles organiques ou oxydables avec flammes et explosions. Chauffé jusqu’à décomposition, dégage des vapeurs toxiques de chlorure de potassium, de chlore et d’oxydes de chlore |
||
|
Potassium |
4.3 |
||
|
Potassium, bromate de |
5.1 |
||
|
Potassium, chlorate de |
Se décompose par chauffage, en brûlant ou par contact avec des substances organiques, des matières combustibles, des poudres métalliques, de l’acide sulfurique, des dérivés de l’ammonium, des alcools, en produisant des flammes et des explosions. Dégagement de vapeurs toxiques par chauffage. Oxydant énergique qui réagit violemment avec les matières combustibles et réductrices |
5.1 |
|
|
Potassium, fluorure de |
6.1 |
||
|
Potassium, hydroxyde de |
Base forte qui réagit violemment avec les acides et qui attaque les métaux comme le zinc, l’aluminium, l’étain et le plomb en présence d’air humide pour former un gaz combustible et explosif (hydrogène). Absorbe rapidement le dioxyde de carbone et l’eau de l’atmosphère. Dégagement de chaleur en présence d’humidité ou d’eau |
8 |
|
|
Potassium, nitrate de |
Se décompose par chauffage ou en brûlant pour donner des oxydes d’azote et de l’oxygène, d’où risque accru d’incendie. Oxydant énergique qui réagit avec les matières combustibles et réductrices |
5.1 |
|
|
Potassium, nitrite de |
Peut exploser par chauffage au-dessus de 530 °C. Se décompose au contact d’acides même faibles, en produisant des vapeurs toxiques (oxydes d’azote). Oxydant énergique qui réagit sur les matières combustibles et réductrices avec risque d’incendie et d’explosion |
5.1 |
|
|
Potassium, oxyde de |
Se décompose au contact de l’eau pour donner de l’hydroxyde de potassium. Base forte en solution dans l’eau, qui réagit violemment avec les acides et qui est corrosive. Attaque de nombreux métaux en présence d’eau |
||
|
Sodium |
4.3 |
||
|
Sodium, bromate de |
5.1 |
||
|
Sodium, carbonate de |
|||
|
Sodium, chlorate de |
La chaleur peut provoquer une combustion violente ou une explosion. Se décompose par chauffage au-dessus de 300 °C ou en brûlant pour donner de l’oxygène avec risque accru d’incendie et de dégagement de vapeurs toxiques (chlore). Oxydant énergique qui réagit violemment sur les matières combustibles et réductrices, avec risque d’incendie et d’explosion. Réagit sur les acides forts avec dégagement de dioxyde de carbone. Réagit avec les contaminants organiques pour former des mélanges sensibles aux chocs. Attaque le zinc et l’acier |
5.1 |
|
|
Sodium, chlorite de |
5.1 |
||
|
Sodium, hydroxyde de |
Base forte qui réagit violemment avec les acides et qui attaque les métaux comme le zinc, l’aluminium, l’étain et le plomb en présence d’air humide pour former un gaz combustible et explosif (hydrogène). Attaque certains types de plastiques, de caoutchoucs ou de revêtements. Absorbe rapidement le dioxyde de carbone et l’eau de l’atmosphère. Dégagement de chaleur en présence d’humidité ou d’eau |
8 |
|
|
Sodium, hypochlorite de |
8 |
||
|
Sodium, méthylate de |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
La chaleur peut provoquer une violente combustion ou une explosion. Se décompose au contact de l’eau pour donner du méthane, d’où risque accru d’incendie. Réducteur énergique qui réagit violemment avec les oxydants. Base forte qui réagit violemment avec les acides et qui est corrosive. Attaque de nombreux métaux en présence d’eau |
4.2/8 |
|
Sodium, nitrate de |
Se décompose par chauffage ou en brûlant pour donner des oxydes d’azote et de l’oxygène, d’où risque accru d’incendie. Oxydant énergique qui réagit sur les matières combustibles et réductrices avec risque d’incendie et d’explosion |
||
|
Sodium, nitrite de |
Peut exploser par chauffage au-dessus de 530 °C. Se décompose au contact d’acides même faibles, en produisant des vapeurs toxiques (oxydes d’azote). Oxydant énergique qui réagit sur les matières combustibles et réductrices avec risque d’incendie et d’explosion |
5.1 |
|
|
Sodium, peroxyde de |
5.1 |
|
Nom chimique et numéro CAS |
Couleur/ aspect |
Point d’ébullition (°C) |
Point de fusion (°C) |
Masse moléculaire (g/mol) |
Solubilité dans l’eau |
Densité (eau = 1) |
Densité de vapeur (air = 1) |
Tension de vapeur (kPa) |
Limites d’explosibilité |
Point d’éclair (°C) |
Température d’auto- inflammation (°C) |
|
Ammoniac |
Gaz incolore, |
–34 à |
– 78 à –77 |
17,03 |
Très soluble |
0,696 x 10-3 |
0,59-0,60 |
856* |
16-28 |
11* |
651 |
|
Ammonium, bicarbonate d’ |
Cristaux orthorhombiques |
107-108 (décomposition) |
79,06 |
Soluble |
1,573-1,586 |
2,7 |
|||||
|
Ammonium, chlorure d’ |
Cristaux ou masse cristalline incolores; poudre blanche, granuleuse; cristaux cubiques; poudre blanche, fine ou grossière, cristalline |
338-340 (sublimation) |
53,49 |
Soluble |
1,519-1,527 |
1,9 |
0,13 à |
||||
|
Ammonium, fluorure d’ |
Feuillets ou aiguilles; prismes hexagonaux obtenus par sublimation; cristaux hexagonaux incolores; cristaux blancs |
(décomposition)* |
37,04 |
Soluble |
1,009-1,015 |
1,3 |
16-27 |
651 |
|||
|
Ammonium, hydroxyde d’ |
Liquide incolore |
–78 à –77 |
35,05 |
Très soluble |
0,89-0,90 |
1,2* |
15,29 |
||||
|
Ammonium, nitrate d’ |
Cristaux incolores orthorhombiques; cristaux monocliniques au-dessus de 32,9 °C; cristaux transparents ou granulés blancs; cinq phases solides existent à la pression normale; cristaux orthorhombiques |
210 (décomposition) |
170 |
80,04 |
Très soluble |
1,725 |
2,8 |
||||
|
Calcium |
Surface brillante, blanc argent quand fraîchement coupé; structure cubique |
1440-1484 |
837-850 |
40,08 |
Réaction |
1,54-1,57 |
1,4 |
1,33 à 983 °C |
|||
|
Calcium, bromate de |
Poudre blanche cristalline |
149 |
38 |
295,88 |
Très soluble |
3,329 |
|||||
|
Calcium, carbonate de |
Poudre blanche ou cristaux incolores |
825-898 (décomposition) |
520* |
100,09 |
Peu soluble |
2,71-2,95 |
|||||
|
Calcium, carbure de |
Masse irrégulière, de grisâtre à |
~2300 |
64,10 |
Réaction |
2,22-2,26 |
2,2 |
325 |
||||
|
Calcium, chlorate de |
340* |
206,98 |
Très soluble |
2,711 |
1,3 Pa* |
||||||
|
Calcium, chlorure de |
Cristaux cubiques, granulés ou masse fondue; incolore |
1935* |
772-782 |
110,98 |
Très soluble |
2,15-2,16 |
|||||
|
Calcium, hydroxyde de |
Cristaux ou granulés mous ou poudre; cristaux hexagonaux, incolores; cristaux orthorhombiques, trigonaux; poudre blanche |
580 |
74,09 |
Peu soluble |
2,08-2,34 |
2,5 |
|||||
|
Calcium, hydrure de |
Masse de grisâtre |
600-675 (décomposition) |
42,09 |
Réaction |
1,7-1,9 |
1,4 |
|||||
|
Calcium, nitrate de |
Granulés; cristaux cubiques incolores; masse blanche |
560-561 |
164,09 |
Très soluble |
2,504 |
8,1 |
|||||
|
Calcium, nitrite de |
Cristaux incolores |
100 |
132,09 |
Très soluble |
2,23 à |
||||||
|
Calcium, oxyde de |
Cristaux cubiques incolores; masse blanche ou grisâtre ou poudre granuleuse |
2850 |
2570- |
56,08 |
Réaction |
3,32-3,35 |
1,9 |
||||
|
Carbonique, acide |
Poudre fine, blanche, microcristalline; poudre ou cristaux; aragonite: cristaux orthorhombiques; calcite: cristaux hexagonaux |
825 |
100,09 |
Insoluble |
2,7-2,9 |
||||||
|
Diammonium, phosphate de |
Incolore, monoclinique; cristaux ou poudre blancs |
155 |
132,06 |
Soluble |
1,619 |
||||||
|
Hydroxylamine |
Grosses paillettes blanches ou aiguilles blanches; liquide incolore |
58 sous |
32-33 |
33,03 |
Soluble |
1,08 |
1,1 |
1,3 à 47 °C |
129 (explosion) |
265 |
|
|
Hydroxylamine, chlorhydrate d’ |
Cristaux |
151-152 (décomposition) |
69,49 |
Soluble |
1,67 |
||||||
|
Hydroxylamine, sulfate d’ |
Cristaux incolores |
177 |
164,13 |
Soluble |
1,86 |
||||||
|
Lithium |
Métal blanc argent; structure cubique centrée; devient jaunâtre au contact de l’air humide; la surface devient de grisâtre à blanc au contact de l’air |
1336-1347 |
179-181 |
6,94 |
Réaction |
0,534 |
0,13 à |
179 |
|||
|
Lithium, carbonate de |
Poudre blanche, légère; monoclinique |
1300-1310 (décomposition) |
720-723 |
73,89 |
Peu soluble |
2,11 |
|||||
|
Lithium, chlorure de |
Cristaux cubiques, granulés ou poudre cristalline; blanc |
1360-1383 |
605-614 |
42,39 |
Soluble |
2,07-2,10 |
0,13 à |
||||
|
Lithium, hydroxyde de |
Cristaux |
1626* |
450-471 |
23,95 |
Soluble |
1,45* |
|||||
|
Lithium, hydroxyde de, monohydraté |
Cristaux |
924 (décomposition) |
462 |
41,96 |
Soluble |
1,51 |
1,4 |
||||
|
Lithium, hydrure de |
Produit du commerce généralement gris; blanc, translucide, masse cristalline ou poudre |
850 (décomposition) |
680-689 |
7,95 |
Réaction |
0,76-0,82 |
0 |
200 |
|||
|
Perchlorique, acide |
Cristaux incolores |
610 (décomposition) |
525* |
138,55 |
Peu soluble |
2,52 |
4,8 |
||||
|
Potassium |
Métal mou, blanc argent; structure cubique centrée |
759-765 |
63-64 |
39,10 |
Réaction |
0,86-0,89 |
1,4 |
1,06 à |
|||
|
Potassium, bromate de |
Cristaux ou granulés blancs; cristaux trigonaux incolores |
434 |
167,00 |
Peu soluble |
3,27 |
5,8 |
|||||
|
Potassium, bromure de |
Cristaux incolores ou granulés ou poudre blancs; cristaux cubiques |
1435* |
730-734 |
119,00 |
Soluble |
2,74,2,75 |
0,13 à |
||||
|
Potassium, carbonate de |
Granulés ou poudre granuleuse; cristaux monocliniques incolores; poudre granuleuse blanche; poudre granuleuse translucide |
(décomposition) |
891-898 |
138,21 |
Très soluble |
2,29 |
|||||
|
Potassium, chlorate de |
Cristaux incolores, brillants ou granulés ou poudre blancs |
400 (décomposition) |
356-368 |
122,55 |
Peu soluble |
2,32 |
4,2 |
||||
|
Potassium, fluorure de |
Cristaux cubiques, incolores, déliquescents |
1502-1505 |
858-860 |
58,10 |
Soluble |
2,481 |
2,0 |
0,13 à |
|||
|
Potassium, hydroxyde de |
Masse blanche ou légèrement jaune, bâtonnets, boulettes, paillettes ou masse fondue; cristaux blancs orthorhombiques; liquide incolore |
1320-1327 |
380-406 |
56,11 |
Très soluble |
2,044 |
0,13 à |
||||
|
Potassium, iodate de |
Cristaux ou poudre cristalline blancs; cristaux monocliniques incolores |
560 |
214,00 |
Peu soluble |
3,89 |
||||||
|
Potassium, iodure de |
Cristaux cubiques incolores ou blancs, granulés blancs ou poudre; cristaux hexaédriques transparents ou légèrement opaques |
1323-1330 |
680-681 |
166,00 |
Très soluble |
3,12 |
0,13 à |
||||
|
Potassium, nitrate de |
Cristaux incolores orthorhombiques ou trigonaux; granulés ou poudre cristalline blancs |
400 (décomposition) |
333-334 |
101,10 |
Soluble |
2,109 |
|||||
|
Potassium, nitrite de |
Granulés ou bâtonnets blancs |
537 (explosion) |
441 |
85,10 |
Très soluble |
1,915 |
2,9 |
||||
|
Potassium, oxyde de |
Poudre cristalline |
350 |
94,20 |
Soluble |
2,32-2,35 |
||||||
|
Potassium, périodate de |
Petits cristaux incolores ou poudre blanche granuleuse |
(explosion) |
582 |
230,00 |
Peu soluble |
3,618 |
7,9 |
580* (explosion) |
|||
|
Sodium |
Blanc argent; structure cubique centrée; surface brillante quand fraîchement coupé |
881-883 |
97-98 |
22,99 |
Réaction |
0,968 |
0,16 à |
43 cf |
>115 |
||
|
Sodium, bicarbonate de |
Prismes blancs monocliniques; poudre cristalline |
50 |
84,01 |
Soluble |
2,159 |
||||||
|
Sodium, bromate de |
Cristaux cubiques incolores; granulés ou poudre cristalline blancs |
381 |
150,89 |
Soluble |
3,339 |
||||||
|
Sodium, carbonate de |
Poudre blanche; poudre blanc grisâtre ou masse contenant jusqu’à 99% de carbonate de sodium |
851 |
105,99 |
Soluble |
2,536 |
||||||
|
Sodium, chlorate de |
Incolore; cristaux cubiques ou trigonaux; poudre blanche; cristaux de blanc à jaune pâle; poudre incolore; cristaux incolores |
300 (décomposition) |
248 |
106,44 |
Très soluble |
2,49-2,50 |
3,7* |
||||
|
Sodium, chlorite de |
Solide blanc cristallin; cristaux |
180-200 (décomposition) |
90,44 |
Soluble |
2,468 |
3,1-3,9 |
~0 |
7-? |
180* |
||
|
Sodium, chlorure de |
Cristaux incolores, transparents ou poudre blanche cristalline |
1413-1465 |
801-804 |
58,44 |
Soluble |
2,165 |
0,13 à |
||||
|
Sodium, éthylate de |
Poudre blanche ou jaunâtre; poudre blanche parfois brunâtre |
>300* |
68,05 |
Réaction |
1,6 |
||||||
|
Sodium, hydroxyde de |
Masse, écailles, boulettes, bâtonnets; paillettes ou gâteaux blancs; solide soudé avec fracture cristalline |
1388-1390 |
318-323 |
40,00 |
Très soluble |
2,12-2,13 |
0,13 à 739 °C* |
||||
|
Sodium, hypochlorite de |
En solution seulement; liquide jaune verdâtre |
(explosion) |
18* |
74,44 |
Soluble |
1,216 |
|||||
|
Sodium, iodure de |
Cristaux cubiques incolores; cristaux ou granulés blancs; poudre blanche |
1304 |
651-660 |
149,89 |
Très soluble |
3,667 |
>1 |
0,13 à |
|||
|
Sodium, méthylate de |
Amorphe, poudre fluante |
127 |
54,02 |
Réaction |
0,97* |
1,1 |
12,7 |
7,3-36 |
33 |
70-80 |
|
|
Sodium, monohydrogénophosphate de |
Incolore ou blanc, sel granuleux |
~35 |
141,96 |
Soluble |
1,5-2,1* |
4,9 |
|||||
|
Sodium, nitrate de |
Cristaux incolores, trigonaux ou rhomboédriques; granulés ou poudre blancs |
380 (décomposition) |
306- |
84,99 |
Très soluble |
2,261 |
2,9 |
||||
|
Sodium, nitrite de |
Prismes, d’incolore à jaune, rhomboédriques; granulés, bâtonnets blancs ou légèrement jaunes ou poudre; cristaux blancs ou légèrement jaunâtres, boulettes, bâtonnets ou poudre |
320 (décomposition) |
271 |
69,00 |
Très soluble |
2,17-2,26 |
2,4 |
490 |
|||
|
Sodium, peroxyde de |
Poudre granuleuse, de jaunâtre à blanc; poudre blanche jaunissant à l’air; poudre, de jaunâtre à blanc jaunissant à chaud |
660-675 (décomposition) |
77,98 |
Réaction |
2,80-2,81 |
||||||
|
Sodium, phosphate de |
~75 |
163,94 |
Soluble |
1,62-2,54* |
|||||||
|
Sodium, tripolyphosphate de |
Poudre et granulés; poudre blanche |
>1000 |
622 |
367,86 |
Soluble |
0,5-1,2* |
|||||
|
Tétraméthylammonium, |
Solide blanc cristallin |
420-425 (décomposition) |
109,60 |
Soluble |
1,169 |