

|
L’Aide-mémoire des produits chimiques est conçu de façon à permettre au lecteur de se référer rapidement à environ 2 000 composés chimiques qui présentent un intérêt commercial. Sur la base de leur formule brute, on a réparti les composés chimiques en «familles» chimiques. Cette répartition est quelque peu arbitraire, car de nombreux composés chimiques peuvent être classés dans plus d’une famille. Au lecteur qui recherche un composé chimique particulier, il est conseillé de consulter l’index des produits chimiques qui se trouve dans le présent volume pour déterminer si ce composé est traité et à quel endroit. Cet index indique également les chapitres des autres volumes de l’Encyclopédie dans lesquels le composé est aussi mentionné. Les chapitres no 63, «Les métaux: propriétés chimiques et toxicité», et no 62, «Les composés minéraux et les produits chimiques à usage agricole», fournissent au lecteur une description systématique de ces éléments et composés. Le chapitre no 61, «L’utilisation, la manipulation et le stockage des produits chimiques», offre une information sur la sécurité de manipulation, d’utilisation, de stockage et de transport des produits chimiques. Pour chaque famille chimique, on trouve un bref exposé des caractéristiques intéressantes sur le plan toxicologique, épidémiologique ou de la sécurité chimique et quatre types de tableaux où sont récapitulées de manière uniforme les données chimiques, physiques, toxicologiques et de sécurité. Pour des raisons de place, les références aux sources ayant servi à la préparation des textes ne sont pas mentionnées. Le lecteur pourra identifier la plupart de ces sources en se reportant à la base de données des substances dangereuses (Hazardous Substances Database (HSDB)), publiée par la Bibliothèque nationale de médecine des Etats-Unis (US National Library of Medicine). Outre la 3e édition de l’Encyclopaedia of Occupational Health and Safety et la littérature scientifique en général, les HSE Reviews, études techniques publiées par la Direction de la sécurité et de la santé du Royaume-Uni (UK Health and Safety Executive (HSE)), ont également été utilisées comme sources d’information. Le chapitre no 22, «L’information et la sécurité au travail», de la présente Encyclopédie et les chapitres mentionnés ci-dessus fournissent d’autres références d’ordre général. Les données concernant les applications industrielles des produits chimiques sont adaptées de celles qui figurent dans la 3e édition de l’Encyclopaedia of Occupational Health and Safety et de la HSDB (pour la description des industries chimiques particulières, voir les chapitres no 77, «L’industrie chimique de transformation», no 78, «Le raffinage du pétrole», no 79, «L’industrie pharmaceutique, et no 80 «L’industrie du caoutchouc».) RemerciementsCe chapitre rassemble des informations tirées, pour une part, d’articles de la 3e édition de l’Encyclopaedia of Occupational Health and Safety et qui, une fois mises à jour, sont présentées de façon uniforme sous forme de tableaux. Auteurs de la 4e édition: Janet L. Collins Les formules développées qui sont présentées dans les tableaux d’identification chimique ont été créées à l’aide de CS ChemDraw Pro® et fournies par ChemFinderTM Web Server, avec l’aimable autorisation de CambridgeSoft Corporation (www.camsoft.com). Auteurs de la 3e édition: M.N. Aldyreva Notes concernant les tableauxLes quatre types de tableaux présentés pour chaque famille sont les suivants: 1. Identification chimiqueCes tableaux donnent les noms chimiques, les synonymes, les numéros ONU, les numéros CAS et la formule brute ou développée. Dans la mesure du possible, les rédacteurs se sont efforcés d’utiliser le même nom chimique pour chaque substance dans tous les exposés du présent Aide-mémoire et de l’Encyclopédie. Toutefois, ils n’ont pas cherché à employer uniquement le système de nomenclature de l’Union internationale de la chimie pure et appliquée (UICPA) (International Union of Pure and Applied Chemistry (IUPAC)). Souvent, le nom fourni par cette dernière ne serait pas familier à ceux qui travaillent dans un établissement commercial où l’on emploie un nom plus simple ou plus courant. Ainsi, le nom qui apparaît comme nom chimique dans les tableaux de chaque famille est souvent un nom plus familier que celui de l’UICPA. La liste des synonymes indiquée dans ces tableaux n’est pas exhaustive, mais comporte certaines dénominations qui ont été attribuées au produit chimique en question. Le numéro d’enregistrement du Chemical Abstracts Service (CAS), ou CAS Registry Number (RN), est un identificateur numérique utilisé dans chaque tableau pour permettre une identification cohérente. Ce numéro CAS est unique; il s’applique aux produits chimiques et aux mélanges et il est employé universellement sous la forme xxx-xx-x, ce qui permet une recherche efficace dans une base de données. Le CAS est un service de la Société chimique américaine (American Chemical Society), qui est une société savante et une association professionnelle, dont le siège se trouve aux Etats-Unis. 2. Risques pour la santéLes données concernant l’exposition de courte durée, l’exposition prolongée, les modes d’exposition et les symptômes qui en résultent ont été adaptées de la série des Fiches internationales de sécurité chimique (International Chemical Safety Cards (ICSC)) produite par le Programme international sur la sécurité chimique (International Programme on Chemical Safety (IPCS)), programme conjoint de l’Organisation mondiale de la santé (OMS), de l’Organisation internationale du Travail (OIT) et du Programme des Nations Unies pour l’environnement (PNUE). Le reste des données concernant les organes cibles, les voies de pénétration et les symptômes qui leur sont associés est issu de l’ouvrage NIOSH Pocket Guide to Chemical Hazards publié par l’Institut national de la sécurité et de la santé au travail (National Institute for Occupational Safety and Health (NIOSH)), 1994, Publication No. 94-16). 3. Risques physiques et chimiquesLes données relatives aux risques physiques et chimiques sont adaptées de la série des Fiches internationales de sécurité chimique (ICSC) produite par le Programme international sur la sécurité chimique (IPCS), programme conjoint de l’OMS, de l’OIT et du PNUE. Les données de la classification des risques sont issues des Recommandations relatives au transport des marchandises dangereuses (Recommendations on the Transport of Dangerous Goods), préparées par le Comité d’experts des Nations Unies en matière de transport des marchandises dangereuses (United Nations Committee of Experts on the Transport of Dangerous Goods) (Organisation des Nations Unies (ONU), 1999, 11e édition). On a utilisé les codes suivants: 1.5 = matières très peu sensibles présentant un risque d’explosion en masse; 2.1 = gaz inflammables; 2.3 = gaz toxiques; 3 = liquides inflammables; 4.1 = matières solides inflammables; 4.2 = matières sujettes à inflammation spontanée; 4.3 = matières qui, au contact de l’eau, dégagent des gaz inflammables; 5.1 = matières comburantes; 6.1 = matières toxiques; 7 = matières radioactives; 8 = matières corrosives. Les Recommandations s’adressent aux gouvernements et aux organismes internationaux concernés par la réglementation du transport des matières dangereuses. Elles comportent les principes de classification et la définition des classes, la liste des principales marchandises dangereuses, les prescriptions générales pour l’emballage, les méthodes d’essai, le marquage, l’étiquetage ou l’affichage, et les documents de transport. Des recommandations spéciales concernent certaines classes de marchandises. Elles ne s’appliquent pas aux marchandises dangereuses en vrac qui, dans la plupart des pays, sont soumises à une réglementation spéciale. Les classes et les divisions suivantes de l’ONU se retrouvent souvent dans les tableaux de produits chimiques du présent Aide-mémoire ainsi que dans le chapitre no 63, «Les métaux: propriétés chimiques et toxicité». Classe 2 — Gaz Division 2.3 — Gaz toxiques: les gaz i) sont connus comme étant toxiques ou corrosifs pour l’homme au point que leur transport présente un risque pour la santé; ou ii) sont présumés toxiques ou corrosifs pour l’homme parce que leur CL50 (selon la définition du paragraphe 2.6.2.1) est égale ou inférieure à 5 000 ml/m3 (ppm). Les gaz répondant aux critères mentionnés ci-dessus en raison de leur corrosivité doivent être classés comme gaz toxiques présentant un risque de corrosivité subsidiaire. Classe 4 — Matières solides inflammables; matières sujettes à l’inflammation spontanée; matières qui, au contact de l’eau, dégagent des gaz inflammables Division 4.2 — Matières sujettes à l’inflammation spontanée: matières susceptibles de s’échauffer spontanément dans des conditions normales de transport, ou de s’échauffer au contact de l’air, et pouvant alors s’enflammer. Division 4.3 — Matières qui, au contact de l’eau, dégagent des gaz inflammables: matières qui, par réaction avec l’eau, sont susceptibles de s’enflammer spontanément ou de dégager des gaz inflammables en quantités dangereuses. Classe 5 — Matières comburantes et peroxydes organiques Division 5.1 — Matières comburantes: matières qui, sans être toujours combustibles elles-mêmes, peuvent, en général en cédant de l’oxygène, provoquer ou favoriser la combustion d’autres matières. Classe 6 — Matières toxiques et matières infectieuses Division 6.1 — Matières toxiques: matières qui peuvent soit causer la mort ou des troubles graves, soit être nuisibles à la santé humaine si elles sont absorbées par ingestion, par inhalation ou par voie cutanée. Classe 8 — Matières corrosives Matières qui, par action chimique, causent de graves dommages aux tissus vivants ou qui, en cas de fuite, peuvent endommager sérieusement, ou même détruire, d’autres marchandises ou les engins de transport, et qui peuvent aussi être à l’origine d’autres risques. Les codes ONU, numéros d’identification que le Comité d’experts des Nations Unies en matière de transport des marchandises dangereuses affecte aux marchandises dangereuses transportées, sont utilisés pour identifier facilement ces produits en cas d’urgence au cours du transport. 4. Propriétés physiques et chimiquesSources consultées pour la 3e édition en langue française Les données figurant dans les tableaux intitulés «Propriétés physiques et chimiques» ont été collationnées à partir d’un certain nombre de sources autorisées; elles n’ont pas été simplement reprises de la 4e édition de l’Encyclopaedia of Occupational Health and Safety, en raison notamment du temps qui s’est écoulé depuis la rédaction de cet ouvrage. Les deux principales publications de référence dans le domaine considéré sont sans conteste le CRC Handbook of Chemistry and Physics (82e édition, 2001-2002) et The Merck Index (13e édition, 2001). Une troisième source, beaucoup moins exhaustive quant au nombre des substances traitées, mais très fiable, est constituée des Fiches toxicologiques de l’INRS (CD-ROM 2001, Institut national de recherche et de sécurité, Paris). Deux autres sources ont été consultées systématiquement sur Internet. Il s’agit des Fiches internationales de sécurité chimique publiées par l’IPCS — programme conjoint de l’OMS, de l’OIT et du PNUE — en collaboration avec la Commission des Communautés européennes (site cdc.gov/niosh/ipcs) et de la base de données Electronic Material Safety Data Sheets de l’Université de Stanford, aux Etats-Unis (site goddard.stanford.edu/msds). Six autres bases de données — cinq américaines et une britannique — ont été interrogées de manière occasionnelle, à des fins de contrôle ou à titre complémentaire, également sur Internet. Présentation des données retenues Quelques remarques seront utiles pour définir les grandeurs physiques figurant dans les tableaux et préciser la démarche suivie. Point d’ébullition. C’est la température à laquelle une substance passe de l’état liquide à l’état de gaz ou de vapeur. C’est aussi la température à laquelle la tension de vapeur du liquide est égale à la pression extérieure. Les valeurs indiquées se réfèrent à la pression atmosphérique normale (1 atm = 101,325 kPa), à moins qu’une pression différente ne soit mentionnée. On rencontrera parfois les mentions «sublimation» ou «décomposition»; on dit qu’il y a sublimation lorsque la substance passe directement de l’état solide à l’état de gaz ou de vapeur sans passer par la phase liquide. Les écarts entre les diverses sources consultées étant parfois considérables, on a indiqué des fourchettes plutôt que des moyennes, une moyenne pouvant laisser entendre qu’il s’agit d’une valeur précise. Point de fusion. C’est la température à laquelle une substance passe de l’état solide à l’état liquide. Inversement, la température de congélation ou de solidification est celle où une substance passe de l’état liquide à l’état solide. Les valeurs données se réfèrent à la pression atmosphérique normale, à moins qu’une pression différente ne soit mentionnée. Masse moléculaire (masse molaire). C’est la masse en grammes d’une mole de la substance considérée, c’est-à-dire de 6,022 x 1023 de ses molécules (nombre d’Avogadro). Elle est donnée en g/mol. Solubilité dans l’eau. C’est le pouvoir qu’a une substance de se dissoudre dans l’eau, généralement à une température voisine de 20 oC, sauf indication contraire. Elle est exprimée ici en termes qualitatifs (insoluble, peu soluble, soluble, très soluble, miscible) plutôt que quantitatifs. Une substance est dite «miscible» (avec l’eau) lorsqu’elle forme avec celle-ci un mélange homogène, et cela en n’importe quelle proportion. La mention «réaction» signale que le contact de la substance avec l’eau provoque une réaction ou une décomposition. Densité (eau = 1). Il s’agit de la densité relative par rapport à l’eau. Lorsque le chiffre indiqué est valable dans la plage 15-25 oC, la température n’est pas précisée. Lorsqu’il s’agit d’un gaz condensé, on donne parfois la densité en phase liquide. Densité de vapeur (air = 1). Il s’agit de la densité de vapeur relative par rapport à l’air, en d’autres termes, du rapport de la masse d’un volume donné de cette vapeur à la masse du même volume d’air. Tension de vapeur. C’est la pression à laquelle des vapeurs s’échappent d’un liquide à une température donnée. Elle est donnée en kPa si elle n’est pas inférieure à 0,1 kPa; dans le cas contraire, elle est indiquée en Pa. La température à laquelle elle a été déterminée n’est précisée que lorsqu’elle s’écarte de la plage 15-25 oC. La tension de vapeur augmente avec la température. Elle est aussi liée à la volatilité de la substance; plus elle est élevée, plus le liquide s’évapore rapidement. Limites d’explosibilité (appelées aussi limites d’inflammabilité). Elles s’entendent en concentrations volumiques dans l’air et définissent les concentrations (inférieure et supérieure) entre lesquelles un gaz ou les vapeurs d’un liquide inflammable sont explosibles dans l’air en présence d’une source d’ignition. Point d’éclair. C’est la température minimale, corrigée pour la pression atmosphérique normale (1 atm = 101,325 kPa), à laquelle une substance volatile combustible dégage des vapeurs susceptibles de constituer avec l’air un mélange inflammable au contact d’une flamme ou d’une étincelle. Point d’éclair, tension de vapeur et limite inférieure d’explosibilité sont des grandeurs interdépendantes. Les différentes sources donnent pour le point d’éclair des valeurs qui varient parfois sensiblement et ne précisent pas toujours la méthode utilisée (coupelle fermée ou coupelle ouverte, par exemple). Pour ces raisons, on a retenu ici, en général, la température la plus basse déterminée en coupelle fermée. Température d’auto-inflammation. C’est la température la plus basse à laquelle une substance s’enflamme spontanément au contact de l’air, c’est-à-dire sans source extérieure d’ignition (flamme, étincelle, paroi chaude, canalisation de vapeur, etc.). Elle est affectée par des facteurs qui ne sont pas nécessairement liés à la substance elle-même (nature du contact matériel, etc.) et peut par conséquent varier selon les conditions expérimentales. Pour terminer, quelques remarques au sujet de la précision des valeurs choisies. Certaines sources consultées donnent parfois, pour les points d’ébullition et de fusion, une précision au dixième de degré Celsius près. Compte tenu des écarts fréquents constatés entre les indications des diverses sources, il a semblé préférable d’arrondir les valeurs retenues au degré près mais d’indiquer par contre, le cas échéant, la plage d’échelonnement des valeurs trouvées (en ignorant celles qui sont extravagantes). Cette manière de faire paraît préférable à la méthode qui consisterait à retenir la moyenne ou même la valeur médiane des valeurs fournies par les sources considérées. La même pratique a été suivie en ce qui concerne les points d’éclair et les températures d’auto-inflammation. Pour les masses moléculaires, les densités de vapeur et les tensions de vapeur, on s’est limité à deux décimales, alors que trois décimales ont été retenues pour les densités par rapport à l’eau et une seule pour les limites d’explosibilité. Enfin, certaines valeurs figurant dans les tableaux sont accompagnées d’un astérisque (*). Il s’agit en général de valeurs au sujet desquelles il subsiste un doute et qui sont, par conséquent, données sous réserve. Cette notation s’applique également à plusieurs substances dont les points d’éclair étaient indiqués sans mention de la méthode de détermination employée. Les abréviations ci-après ont été utilisées dans les tableaux: co = coupelle ouverte; cf = coupelle fermée; vx = vieux; nd = non disponible. Les points d’ébullition ont tous été arrondis au degré Celsius le plus proche. Lorsque plus d’un chiffre est indiqué, la fourchette englobe les valeurs proposées par les différentes sources, à l’exclusion toutefois de celles qui sont visiblement extravagantes. |
Les acides organiques et leurs dérivés représentent une gamme étendue de substances. Dans l’industrie chimique, on les utilise pour la fabrication de produits chimiques de presque toute nature. Les acides organiques étant de structure variée, leur action toxique revêt des formes diverses. Ce sont en général des irritants primaires, l’intensité de leur action étant déterminée en partie par la dissociation de l’acide et sa solubilité dans l’eau. Certains peuvent causer de graves lésions tissulaires, similaires à celles provoquées par les acides minéraux forts. Ils peuvent avoir également une action sensibilisatrice, mais cet effet est plus courant pour les anhydrides que pour les acides.
Aux fins du présent article, les acides organiques ont été répartis en acides monocarboxyliques saturés et monocarboxyliques insaturés, acides aliphatiques dicarboxyliques, acides acétiques halogénés, divers acides monocarboxyliques aliphatiques et acides carboxyliques aromatiques. De nombreux acides carboxyliques présentent de l’importance en raison de leur utilisation dans les aliments, boissons, médicaments et dans toute une série de procédés de fabrication. Les acides suivants comptent parmi les plus courants: acide adipique, acide azélaïque, acide fumarique, acide itaconique, acide maléique, acide malique, acide malonique, acide oxalique, acide pimélique, acide sébacique, acide succinique, acide tartrique et acide thiomalique.
Les acides monocarboxyliques saturés à longue chaîne sont des acides gras et, pour la plupart, ils sont d’origine naturelle. On peut également obtenir des acides gras synthétiques par oxydation à l’air de paraffines (hydrocarbures aliphatiques) en présence de catalyseurs métalliques ou encore par oxydation d’alcools avec de la soude caustique.
Les acides organiques sont utilisés dans l’industrie des matières plastiques, du tannage, l’industrie textile, l’industrie du papier, le travail des métaux, l’industrie pharmaceutique, l’industrie alimentaire, les boissons et les produits cosmétiques. On trouve également les acides organiques dans les parfums, les herbicides, les colorants, les lubrifiants et les produits d’entretien.
L’acide formique et l’acide acétique comptent parmi les principaux composés chimiques industriels appartenant au groupe des acides monocarboxyliques saturés. L’acide formique trouve ses principales applications dans les industries textile et du cuir. On l’utilise dans la teinture par épuisement d’un certain nombre de fibres naturelles et synthétiques et comme agent réducteur dans la coloration au chrome. Il est employé comme agent de déchaulage et de neutralisation dans l’industrie du cuir ainsi que comme coagulant du latex. Il trouve également une utilisation dans la fabrication de fumigènes et d’insecticides. L’acide acétique joue le rôle d’intermédiaire, d’agent de déchaulage lors du tannage du cuir, de solvant et d’acidifiant dans les puits de pétrole. On l’emploie aussi comme additif dans divers aliments et apprêts, ou comme catalyseur et additif de finition dans la fabrication des colorants et l’industrie textile.
A faible concentration (le vinaigre est une solution à environ 4 à 6%), l’acide acétique est obtenu par fermentation aérobie (Acetobacter) de solutions alcooliques. L’acide acétique est l’un des acides organiques les plus utilisés. On l’emploie dans la production d’acétate de cellulose, d’acétate de vinyle, d’acétates minéraux ou organiques et d’anhydride acétique. L’acide acétique lui-même est utilisé dans la teinture, l’industrie pharmaceutique, en conserverie, dans le conditionnement des denrées alimentaires et pour la production de pigments.
L’acide chloracétique intervient comme intermédiaire dans l’industrie pharmaceutique, dans la production de colorants et dans l’industrie chimique en général. L’acide salicylique est aussi un intermédiaire employé dans la synthèse de l’aspirine et dans les industries du caoutchouc et des colorants. L’acide benzoïque, l’acide nonanoïque, l’acide L-ascorbique et l’acide 9-octadécénoïque (acide oléique) sont d’autres composés qui servent dans les industries alimentaire et pharmaceutique.
L’acide palmitique et l’acide stéarique trouvent une large gamme d’applications dans les savons, les cosmétiques, les détergents, les lubrifiants, les revêtements de protection et les produits chimiques intermédiaires. L’acide propionique est utilisé en synthèse organique ainsi que comme inhibiteur de moisissure et conservateur alimentaire. L’acide acrylique, l’acide méthacrylique et l’acide crotonique servent dans la fabrication de résines et de plastifiants dans les industries du papier, des matières plastiques et des peintures. L’acide acrylique entre également dans la composition d’encaustiques. L’acide crotonique est utilisé dans la fabrication d’assouplissants pour caoutchouc synthétique. L’acide lactique, l’acide butyrique et l’acide gallique sont employés dans le tannage du cuir. L’acide lactique est également utilisé dans les adhésifs, les matières plastiques et les textiles. On l’emploie aussi comme acidulant alimentaire et pour acidifier les puits de pétrole. L’acide glycolique sert dans l’industrie du cuir, l’industrie textile, la galvanoplastie, les adhésifs et le nettoyage des métaux.
Les acides dicarboxyliques (acide succinique, acide maléique, acide fumarique, acide adipique) et l’acide citrique sont utilisés dans les industries alimentaire et pharmaceutique. L’acide succinique entre également dans la fabrication des peintures et vernis. L’acide maléique est employé dans la fabrication de résines synthétiques et en synthèse organique. Il sert de conservateur pour les huiles et les graisses; ses sels sont employés pour la teinture du coton, de la laine et de la soie. L’acide fumarique est utilisé dans les polyesters et les résines alkydes, dans les revêtements de surfaces en matière plastique, comme acidulant alimentaire, dans les encres et en synthèse organique. L’acide adipique sert surtout à la fabrication du nylon, tandis que, en faibles quantités, il trouve une utilisation dans les plastifiants, les lubrifiants synthétiques, les polyuréthanes et les acidulants alimentaires.
L’acide oxalique est un agent de lessivage dans le finissage, le dégommage et le nettoyage des textiles et entre dans la composition de préparations à usage domestique pour le nettoyage de métaux. Il est également utilisé dans les industries du papier, de la photographie et du caoutchouc. L’acide oxalique est employé dans l’impression et la teinture des cotons indiens, la décoloration des chapeaux de paille et du cuir et pour le nettoyage du bois. L’acide aminoacétique intervient comme tampon chimique et en synthèse. L’acide peracétique est utilisé comme décolorant, catalyseur et oxydant.
L’acide naphténique industriel se présente généralement sous la forme d’un mélange malodorant, de couleur foncée, contenant plusieurs acides naphténiques. Les acides naphténiques sont formés à partir de cycloparaffines contenues dans le pétrole, probablement par oxydation. Les acides industriels sont généralement des mélanges épais qui peuvent être séparés en différentes fractions selon que leur point d’ébullition est élevé ou bas. Leur masse moléculaire va de 180 à 350. Ils sont utilisés principalement dans la préparation de siccatifs pour peintures, où leurs sels métalliques, tels que les sels de plomb, de cobalt et de manganèse, agissent comme agents oxydants. Les sels métalliques des acides naphténiques sont employés comme catalyseurs dans divers procédés chimiques. Leur solubilité dans l’huile est un avantage du point de vue industriel.
Un anhydride est défini comme un oxyde qui, lorsqu’il se combine avec l’eau, produit un acide ou une base. Les anhydrides d’acides sont obtenus par élimination d’une molécule d’eau à partir de deux molécules de l’acide correspondant, comme par exemple:
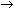 Mn2O7 + H2O
Mn2O7 + H2ODu point de vue industriel, les anhydrides les plus importants sont les anhydrides acétique et phtalique. L’anhydride acétique est utilisé pour la production de matières plastiques, d’explosifs et de parfums, dans les industries alimentaire, textile et pharmaceutique et comme intermédiaire. L’anhydride phtalique est employé comme plastifiant dans la polymérisation du chlorure de vinyle. Il est également utilisé dans la production de résines polyesters saturées ou insaturées, de l’acide benzoïque, de pesticides et de certaines essences et parfums. On l’emploie aussi dans la production des colorants à base de phtalocyanine et des résines alkydes qui entrent dans la composition des peintures et des vernis. L’anhydride maléique a lui aussi un grand nombre d’applications.
L’anhydride propionique est utilisé dans la fabrication de parfums, de résines alkydes, de médicaments et de colorants, tandis que les anhydrides maléique, trimellitique et acétique trouvent une utilisation dans l’industrie des matières plastiques. L’anhydride trimellitique (TMA) est également employé dans les colorants, en imprimerie et dans la confection des garnitures intérieures et des capitonnages pour automobiles. Il est utilisé comme durcisseur pour des résines époxy et d’autres résines, dans les plastifiants vinyliques, les peintures, revêtements, colorants, pigments et divers autres produits manufacturés. Certains de ces produits trouvent des applications dans les matières plastiques résistant aux températures élevées, l’isolation des câbles et les garnitures.
Les acides monocarboxyliques de faible masse moléculaire sont des irritants primaires et peuvent provoquer des lésions tissulaires graves. Leur manipulation exige de grandes précautions; un équipement de protection adapté doit être à la disposition du personnel et toute projection sur la peau ou dans l’œil doit être lavée abondamment à l’eau. Les acides les plus importants de ce groupe sont l’acide acétique et l’acide formique.
Les acides monocarboxyliques saturés à longue chaîne (acides gras) ne sont pas irritants et ne sont que très faiblement toxiques. Leur utilisation industrielle semble poser peu de problèmes.
Les acides monocarboxyliques insaturés sont des substances très réactives et, en solution concentrée, ils sont fortement irritants pour la peau, les yeux et les voies respiratoires. Les risques semblent associés aux expositions aiguës plutôt que cumulées.
La majeure partie de ces acides ne présente qu’un risque minimal en cas d’exposition chronique de faible niveau, et beaucoup d’entre eux sont des constituants normaux des processus métaboliques humains. Toutefois, un certain nombre de ces acides sont des irritants primaires, en particulier en solution concentrée ou sous forme de poussières. La sensibilisation est rare. Etant donné que, à la température ambiante, ils sont tous à l’état solide, le contact a généralement lieu avec des poussières ou des cristaux.
Les vapeurs d’acide acétique peuvent former avec l’air des mélanges détonants et provoquer des incendies, directement ou à cause du dégagement d’hydrogène. L’acide acétique glacial ou l’acide acétique sous forme concentrée sont des irritants cutanés primaires et provoquent par contact un érythème (des rougeurs), des brûlures chimiques et des phlyctènes. A la suite d’ingestion accidentelle, on a observé de graves lésions ulcéro-nécrotiques des voies digestives supérieures, avec hématémèse, diarrhée, choc et hémoglobinurie suivie de troubles urinaires (anurie et urémie).
Les vapeurs sont irritantes pour les muqueuses exposées, notamment la conjonctive, le rhyno-pharynx et les voies aériennes supérieures. Une broncho-pneumonie aiguë a été observée chez une femme à qui l’on avait fait inhaler des vapeurs d’acide acétique à la suite d’un évanouissement.
Chez des travailleurs exposés pendant des années à des concentrations allant jusqu’à 200 ppm, on a constaté un œdème palpébral avec hypertrophie des ganglions lymphatiques, hyperémie des conjonctives, pharyngite chronique, bronchite catarrhale chronique et, dans certains cas, bronchite asthmatique et taches noirâtres d’érosion sur les faces vestibulaires des dents (incisives et canines).
L’accoutumance aux vapeurs d’acide acétique est remarquable; toutefois, une telle accoutumance ne signifie pas que des effets toxiques ne se produiront pas. Après des expositions répétées, par exemple, les travailleurs se plaignent de troubles digestifs avec pyrosis et constipation. Au niveau de la paume, où l’exposition est la plus importante, la peau devient sèche, gercée et hyperkératinisée, et les petites coupures ou abrasions cutanées guérissent lentement.
Le risque principal de l’acide formique est celui de lésions primitives graves de la peau, des yeux et des muqueuses. La sensibilisation est rare, mais peut se produire chez des sujets préalablement sensibilisés au formaldéhyde. Les blessures accidentelles sont comparables à celles que l’on observe avec d’autres acides relativement forts. Aucun effet retardé ou chronique n’a été noté. L’acide formique est un liquide inflammable, et ses vapeurs forment un mélange inflammable et détonant avec l’air.
L’acide propionique en solution présente des propriétés corrosives vis-à-vis de plusieurs métaux. Il est irritant pour les yeux, les voies respiratoires et la peau. Il y a lieu d’appliquer les mêmes mesures de précaution que celles recommandées pour l’acide formique, en tenant compte du point d’éclair moins élevé de l’acide propionique.
L’acide maléique est un acide fort qui provoque une irritation marquée de la peau et des muqueuses. Des atteintes oculaires graves peuvent déjà se produire à des concentrations de 5%. On n’a pas signalé de toxicité cumulée chez l’être humain. Le risque industriel est celui de l’irritation primaire des surfaces exposées, que l’on peut prévenir par un équipement de protection individuelle adapté, généralement des gants ou des gants à manchettes imperméables.
L’acide fumarique est un acide relativement faible et peu soluble dans l’eau. C’est un métabolite normal et il est moins toxique par voie orale que l’acide tartrique. Il s’agit d’un irritant modéré de la peau et des muqueuses, et l’on ne connaît pas de risques liés à son utilisation industrielle.
L’acide adipique n’est pas irritant et présente une très faible toxicité par voie orale.
Les acides acétiques halogénés sont très réactifs. Ils comprennent l’acide chloracétique, l’acide dichloracétique (DCA), l’acide tri- chloracétique (TCA), l’acide bromacétique, l’acide iodoacétique, l’acide fluoracétique et l’acide trifluoracétique (TFA).
Les acides acétiques halogénés provoquent des lésions graves de la peau et des muqueuses et, en cas d’ingestion, ils peuvent perturber le fonctionnement des enzymes essentielles de l’organisme. Leur manipulation exige de grandes précautions. Ils doivent être préparés et utilisés dans des ateliers hermétiquement clos, dont les ouvertures devraient être limitées aux nécessités de la manipulation. L’enceinte de l’installation doit être mise sous aspiration de façon que les fumées ou les poussières ne puissent pas s’échapper par les ouvertures. Les opérateurs devraient porter un équipement de protection individuelle; des équipements de protection pour les yeux et pour le système respiratoire doivent être disponibles en cas de nécessité.
Les acides di- et trifluoracétiques ont une plus faible toxicité que l’acide fluoracétique (acide monofluoracétique). L’acide fluoracétique et ses composés sont stables, fortement toxiques et insidieux. Au moins quatre plantes d’Afrique du Sud et d’Australie doivent leur toxicité à cet acide (Dichapetalum cymosum, Acacia georginae, Palicourea marcgravii); on a découvert en Australie-Occidentale que plus de trente espèces de Gastrolobium et d’Oxylobrium renferment des quantités variées de fluoracétate.
Le mécanisme biologique responsable des symptômes de l’intoxication au fluoracétate est lié à ce que l’on appelle la «synthèse létale» de l’acide fluorocitrique, lequel bloque le cycle des acides tricarboxyliques en inhibant l’enzyme aconitase. La perte d’énergie, qui résulte de cet arrêt du cycle de Krebs, est suivie d’un dysfonctionnement cellulaire mortel. Il est impossible d’indiquer la dose toxique précise de l’acide fluoracétique pour l’être humain; elle se situe probablement entre 2 et 10 mg/kg; toutefois, plusieurs autres fluoracétates sont encore plus toxiques. L’inhalation, l’ingestion ou la résorption par des lésions de la peau ou à travers la peau saine d’une ou de deux gouttes de ce poison peut être fatale.
D’après des études de cas réalisées en milieu hospitalier, il apparaît que les principaux effets toxiques des fluoracétates pour l’être humain concernent le système nerveux central et le système cardio-vasculaire. Les convulsions épileptiformes graves alternent avec coma et dépression; la mort peut être provoquée par asphyxie pendant une convulsion ou une insuffisance respiratoire. Toutefois, les caractéristiques les plus remarquables sont des irrégularités cardiaques, notamment une fibrillation ventriculaire conduisant à la mort soudaine par arrêt cardiaque. Ces symptômes (que l’on ne peut distinguer de ceux qui sont fréquemment rencontrés dans le domaine clinique) sont généralement précédés d’une période initiale de latence pouvant aller jusqu’à six heures, caractérisée par des nausées, des vomissements, une sialorrhée, des engourdissements, des sensations de picotement, des douleurs épigastriques et un sentiment d’anxiété; les autres symptômes qui peuvent apparaître par la suite consistent en contractions musculaires, hypotension et troubles visuels.
L’acide chloracétique est un composé très réactif qui doit être manipulé avec précaution. Les travailleurs en contact avec des solutions concentrées de ce composé doivent obligatoirement porter des gants, des lunettes de protection, des bottes en caoutchouc et des surtouts imperméables.
L’acide glycolique est un acide plus fort que l’acide acétique qui provoque des brûlures chimiques très graves de la peau et des yeux. On ne lui connaît pas d’effet cumulatif et on pense qu’il est métabolisé en glycine. Sa manipulation exige beaucoup de précautions. Il s’agit pratiquement des mêmes que pour l’acide acétique. Les solutions concentrées peuvent également provoquer des brûlures de la peau et des yeux. La manipulation des solutions concentrées de cet acide nécessite également le port d’un équipement de protection individuelle.
L’acide sorbique est utilisé comme fongicide alimentaire. C’est un irritant primaire de la peau et certaines personnes peuvent acquérir une sensibilisation à ce produit. Par conséquent, le contact avec la peau doit être évité.
L’acide salicylique est un puissant irritant lorsqu’il entre en contact avec la peau ou les muqueuses. Il doit être manipulé avec beaucoup de précautions.
Les anhydrides d’acide ont un point d’ébullition plus élevé que les acides correspondants. Leur action physiologique s’apparente en général à celle des acides correspondants mais, en phase gazeuse, ils sont plus irritants pour les yeux et peuvent causer des conjonctivites chroniques. Ils sont lentement hydrolysés au contact des tissus et peuvent occasionnellement provoquer une sensibilisation. Il faut prévoir une ventilation suffisante et des équipements de protection individuelle. Dans certaines circonstances, en particulier pour le personnel d’entretien, une protection oculaire et respiratoire est nécessaire.
Chez les travailleurs employés à la production d’acide et d’anhydride phtaliques, on a fait état de cas de conjonctivite, de sécrétions nasales sanglantes, d’atrophie de la muqueuse nasale, d’enrouement, de toux et de bronchite. Il est reconnu que l’anhydride phtalique peut provoquer un asthme bronchique et on a observé une sensibilisation de la peau après exposition prolongée; la lésion est généralement une dermite allergique. Une IgE spécifique de l’anhydride phtalique a également été mise en évidence.
L’anhydride phtalique est inflammable et présente un risque modéré d’incendie. Sa toxicité est relativement faible par rapport à celle d’autres anhydrides d’acide industriels, mais il est irritant pour la peau, les yeux et les voies aériennes supérieures. L’anhydride phtalique est sans effet sur la peau sèche, mais provoque des brûlures sur la peau humide; il est donc probable que le véritable responsable de l’irritation soit l’acide phtalique formé au contact de l’eau.
L’anhydride phtalique doit être stocké dans un endroit frais, bien ventilé, à l’écart des flammes nues et des substances oxydantes. Il est recommandé de le manipuler avec une bonne ventilation générale complétée par une aspiration localisée. Dans beaucoup de procédés, on emploie l’anhydride phtalique non pas en paillettes, mais sous forme liquide. En pareil cas, il est livré à l’usine en citernes et introduit directement dans le réseau de canalisations par pompage, ce qui élimine tout risque de contact et toute pollution de l’air par les poussières. Cette pratique a conduit à la disparition complète des symptômes d’irritation parmi les travailleurs de ces usines. Cependant, il ne faut pas oublier que les vapeurs qui se dégagent de l’anhydride phtalique liquide sont tout aussi irritantes que les paillettes; il importe donc d’éviter toute fuite dans le réseau de canalisations. En cas de projections ou de contact avec la peau, un lavage immédiat à grande eau s’impose.
Les travailleurs qui manipulent de l’acide ou de l’anhydride phtaliques doivent être placés sous surveillance médicale. On veillera en particulier aux symptômes asthmatiformes et à la sensibilisation cutanée. La présence de ces symptômes est un motif de mutation à un autre poste. Eviter le contact avec la peau est une nécessité permanente. Le personnel doit être doté de vêtements de protection appropriés et, notamment, de gants en caoutchouc. Un examen médical d’embauche est nécessaire pour éviter que les sujets atteints d’asthme bronchique, d’eczéma ou de toute autre affection allergique soient exposés à de l’anhydrique phtalique.
Lorsqu’il est exposé à la chaleur, l’anhydride acétique peut dégager des vapeurs toxiques susceptibles de provoquer une explosion en présence d’une flamme. Il peut réagir violemment avec des acides forts et des oxydants énergiques tels que l’acide sulfurique, l’acide nitrique, l’acide chlorhydrique, les permanganates, le trioxyde de chrome et le peroxyde d’hydrogène, ainsi qu’avec la soude.
L’anhydride acétique est un puissant irritant qui a des effets corrosifs en cas de contact oculaire; ces effets sont généralement retardés; le contact est suivi de larmoiement, de photophobie, de conjonctivite et d’œdème cornéen. L’inhalation peut provoquer une irritation du rhino-pharynx et des voies aériennes supérieures, avec sensations de brûlure, toux et dyspnée; l’exposition prolongée peut conduire à l’œdème pulmonaire. L’ingestion provoque douleurs, nausées et vomissements. L’exposition prolongée de la peau peut entraîner une dermatite.
Il est recommandé aux personnes pouvant être en contact avec ce produit de porter des vêtements et des lunettes de protection et d’avoir à proximité des fontaines oculaires et des douches d’urgence. Des appareils respiratoires à cartouche chimique peuvent fournir une protection appropriée aux concentrations allant jusqu’à 250 ppm; des appareils respiratoires avec alimentation en air et masque complet sont recommandés pour des concentrations de 1 000 ppm; des appareils respiratoires autonomes sont nécessaires en cas d’incendie.
L’anhydride butyrique est produit par hydrogénation catalytique de l’acide crotonique. L’anhydride butyrique et l’anhydride propionique présentent des risques similaires à ceux de l’anhydride acétique.
L’anhydride maléique peut causer de graves brûlures des yeux et de la peau qui peuvent être produites soit par des solutions, soit par des paillettes de la matière en fabrication entrant en contact avec la peau humide. Des cas de sensibilisation cutanée ont été observés. De grandes précautions doivent être prises pour empêcher le contact de la solution avec la peau et les yeux. Les travailleurs doivent porter des lunettes et des vêtements de protection appropriés; l’accès aux flacons contenant des solutions pour lavage oculaire doit être facile. En fine suspension dans l’air, l’anhydride maléique est capable de former des mélanges détonants. Les condenseurs dans lesquels la matière sublimée se dépose sous forme de cristaux doivent être situés à des emplacements sûrs, hors des locaux occupés.
On a signalé des cas d’œdème pulmonaire provoqués par l’anhydride trimellitique (TMA) chez des travailleurs à l’issue d’une exposition aiguë importante, et une sensibilisation des voies respiratoires après exposition pendant plusieurs semaines, accompagnée de rhinite ou d’asthme. Plusieurs incidents dus aux effets d’une exposition professionnelle au TMA se sont produits. Des expositions multiples par voie respiratoire à une résine époxy contenant du TMA appliqué au pistolet sur des tuyauteries chaudes ont provoqué un œdème pulmonaire chez deux travailleurs. Le degré d’exposition n’a pas été précisé mais, comme il n’a pas été fait mention d’irritation des voies aériennes supérieures, il est possible qu’il y ait eu une réaction d’hypersensibilisation. Selon une autre étude, quatorze travailleurs employés à la synthèse du TMA ont présenté des symptômes respiratoires résultant d’une sensibilisation à ce composé. Dans cette étude, on a noté trois réactions différentes. La première, consistant en rhinite ou asthme, s’est manifestée plusieurs semaines, voire plusieurs années après l’exposition. Une fois sensibilisés, les travailleurs exposés ont présenté, immédiatement après exposition au TMA, des symptômes qui ont cessé avec l’arrêt de cette dernière. Une seconde réaction, impliquant également une sensibilisation, a provoqué des symptômes retardés (toux, éternuements et respiration laborieuse) de quatre à huit heures après cessation de l’exposition. La troisième réaction a consisté en effets irritants consécutifs à une forte exposition initiale.
Une étude concernant les effets nocifs sur la santé et comportant également le dosage du TMA dans l’air a été conduite par l’Institut national de la sécurité et de la santé au travail (National Institute for Occupational Safety and Health (NIOSH)), aux Etats-Unis. Treize travailleurs employés à la fabrication d’une peinture époxy se sont plaints d’irritation des yeux, de la peau, du nez et de la gorge, d’essoufflement, d’éternuements, de toux, d’aigreurs d’estomac, de nausées et de céphalées. Le niveau d’exposition aux suspensions présentes dans l’air était en moyenne de 1,5 mg/m3 (avec une fourchette allant de «non décelé» à 4,0 mg/m3) pendant la fabrication et de 2,8 mg/m3 de TMA (avec une fourchette allant de «non décelé» à 7,5 mg/m3) pendant les opérations de décontamination.
L’expérimentation sur le rat a mis en évidence une hémorragie intra-alvéolaire après exposition subaiguë au TMA à une concentration de 0,08 mg/m3. La tension de vapeur à 20 °C (4 x 10–6 mm Hg) correspond à une concentration légèrement supérieure à 0,04 mg/m3.
L’acide oxalique et ses dérivés sont des acides forts qui, à l’état solide ou en solution concentrée, peuvent causer des lésions caustiques de la peau, des yeux et des muqueuses; une concentration d’acide oxalique ne dépassant pas 5 à 10% peut être irritante en cas d’exposition prolongée. Des décès se sont produits après ingestion de seulement 5 g d’acide oxalique. Les symptômes apparaissent rapidement et sont marqués par un état de choc, une perte de conscience et des crises de convulsions. Ces cas peuvent être accompagnés de lésions rénales importantes, dues à la précipitation tubulaire d’oxalate de calcium. Les crises de convulsions sont probablement dues à l’hypocalcémie. Une exposition chronique de la peau à des solutions d’acide oxalique ou d’oxalate de potassium peut provoquer une douleur localisée et une cyanose des doigts, ou même une gangrène. Cette pathologie serait due à une résorption locale d’acide oxalique entraînant une artérite. Les atteintes chroniques générales dues à l’inhalation de poussières d’acide oxalique se révèlent très rares, mais on a décrit le cas d’un homme qui, après avoir été exposé à des vapeurs chaudes d’acide oxalique (probablement sous forme d’aérosols), a présenté des symptômes tels que perte de poids et inflammation chronique des voies aériennes supérieures. En raison du caractère fortement acide de la poussière d’acide oxalique, l’exposition des travailleurs doit être soigneusement contrôlée et la concentration sur le lieu de travail doit être maintenue dans les limites acceptables pour la santé.
L’oxalate de diéthyle est légèrement soluble dans l’eau; il est miscible en toutes proportions à de nombreux solvants organiques; c’est un liquide incolore, instable, huileux. Il est obtenu en estérifiant l’alcool éthylique par l’acide oxalique. A l’instar d’autres oxalates liquides, il est utilisé comme solvant de nombreuses résines naturelles et synthétiques.
Les symptômes observés chez le rat après ingestion de grandes quantités d’oxalate de diéthyle consistent en troubles respiratoires et fasciculation. On a retrouvé des dépôts importants d’oxalate dans les tubules rénaux du rat après administration par voie orale d’une dose de 400 mg/kg. Chez des travailleurs exposés pendant plusieurs mois à 0,76 mg/l d’oxalate de diéthyle et qui se plaignaient de faiblesse, de céphalées et de nausées, on a observé une légère modification de la numération sanguine. En raison de la très faible tension de vapeur de cette substance à la température ambiante, il est possible que les valeurs de la concentration dans l’air qui sont indiquées soient en fait erronées. Dans cette opération, de l’acétate de diamyle et du carbonate de diéthyle ont été également utilisés.
Tous les acides devraient être stockés à l’écart des sources d’ignition et des substances oxydantes. Les locaux de stockage doivent être bien ventilés pour éviter l’accumulation de concentrations dangereuses. Les récipients doivent être en acier inoxydable ou en verre. En cas de fuite ou de déversement, l’acide acétique doit être neutralisé par une solution alcaline. Des fontaines oculaires et des douches d’urgence doivent être installées pour traiter les cas de contact avec la peau ou les yeux. Le marquage et l’étiquetage des récipients est essentiel; pour toute forme de transport, l’acide acétique est classé comme matière dangereuse.
Pour éviter les lésions de l’arbre respiratoire et des muqueuses, la concentration atmosphérique des acides et anhydrides organiques à forte tension de vapeur doit être maintenue à un niveau inférieur au niveau maximal autorisé, en mettant en œuvre les pratiques d’hygiène industrielle habituelles, comme l’aspiration localisée et la ventilation générale, qui seront accompagnées de la détermination périodique des concentrations atmosphériques d’acide acétique. La recherche et le dosage, en l’absence d’autres vapeurs d’acide, peuvent s’effectuer en faisant barboter de l’air dans une solution alcaline et en mesurant la teneur résiduelle en alcali; en présence d’autres acides, il est nécessaire de recourir à une distillation fractionnée; toutefois, il existe maintenant une méthode faisant appel à la chromatographie en phase gazeuse qui permet le dosage dans l’air ou dans l’eau. L’exposition aux poussières doit également être limitée.
Les personnes travaillant avec de l’acide pur ou des solutions concentrées doivent porter des vêtements de protection, des protections oculaires et faciales, des protections pour les mains et les bras et un appareil de protection respiratoire. Des installations sanitaires appropriées doivent être mises à la disposition du personnel et une bonne hygiène individuelle est conseillée.
|
Nom chimique |
Synonymes et numéro ONU |
Numéro CAS |
Formule développée |
|
Acide acétique |
Acide éthanoïque; acide méthanecarboxylique |
|
|
|
Acide acétylsalicylique |
Acide o-acétoxybenzoïque; acide 2-acétoxybenzoïque; aspirine |
|
|
|
Acide acrylique |
Acide éthylènecarboxylique; acide propénoïque; acide 2-propénoïque |
|
|
|
Acide adipique |
Acide 1,4-butanedicarboxylique; acide hexanedioïque; acide 1,6-hexanedioïque |
|
|
|
Acide L-ascorbique |
Acide L-xylo-ascorbique; vitamine C; acide hexuronique |
|
|
|
Acide benzoïque |
Acide benzènecarboxylique; acide phénylformique; acide benzèneméthanoïque; acide phénylcarboxylique; acide phénylformique |
|
|
|
Acide p-tertio-butyl benzoïque |
p-TBBA; acide p-tert-benzoïque |
|
|
|
Acide butyrique |
Acide butanoïque; acide n-butyrique; acide éthylacétique; acide 1-propanecarboxylique; acide propylformique |
|
|
|
Acide n-caproïque |
Acide butylacétique; acide n-hexanoïque; acide hexylique; acide pentanecarboxylique; acide pentylformique |
|
|
|
Acide chloracétique |
Acide monochloracétique; acide monochloréthanoïque |
|
|
|
Acide chlorendique |
Acide 1,4,5,6,7,7-hexachloro-5-norbornène-2,3-dicarboxylique; acide hexachloro-endo-méthylènetétrahydrophtalique |
|
|
|
Acide 4-chloro-2-méthylphénoxyacétique |
Acide 4-chloro-o-crésoxyacétique; acide 4-chloro-o-tolyloxyacétique; MCPA |
|
|
|
Acide m-chlorobenzoïque |
Acide 3-chlorobenzoïque |
|
|
|
Acide o-chlorobenzoïque |
2-CBA; acide 2-chlorobenzoïque |
|
|
|
Acide p-chlorobenzoïque |
p-Carboxychlorobenzène; acide 4-chlorobenzoïque |
|
|
|
Acide 2-chloropropionique |
Acide α-chloropropionique |
|
|
|
Acide citrique |
Acide 2-hydroxy-1,2,3-propanetricarboxylique; acide β-hydroxytricarballylique |
|
|
|
Acide citrique, hydraté |
Acide 2-hydroxy-1,2,3-propanetricarboxylique monohydraté |
|
|
|
Acide crotonique |
Acide α-buténoïque; acide β-méthylacrylique; acide 3-méthylacrylique |
|
|
|
Acide dichloracétique |
Acide bichloracétique; acide 2,2-dichloracétique; acide dichloréthanoïque |
|
|
|
Acide 2,4-dichlorophénoxyacétique |
Acide dichlorophénoxyacétique; 2,4-D |
|
|
|
Acide 2,4-dichlorophénoxypropionique |
Dichloroprop |
|
|
|
Acide 2-diméthylamino-éthyl-méthacrylique |
|
|
|
|
Acide éthanedioïque, dihydraté |
|
|
|
|
Acide 2-éthylhexoïque |
Acide butyléthylacétique; acide α-éthylcaproïque; acide 2-éthylhéxanoïque |
|
|
|
Acide fluoracétique |
Acide fluoréthanoïque; acide monofluoroacétique |
|
|
|
Acide formique |
Acide aminique; acide méthanoïque |
|
|
|
Acide fumarique |
Acide trans-butènedioïque; acide trans-1,2-éthylènedicarboxylique; acide 1,2-éthylènedicarboxylique |
|
|
|
Acide gallique |
Acide 3,4,5-trihydroxybenzoïque |
|
|
|
Acide glycolique |
Acide hydroxyacétique; acide hydroxyéthanoïque |
|
|
|
Acide heptanoïque |
Acide heptylique; acide 1-hexanecarboxylique; acide œnanthique; acide œnanthylique |
|
|
|
Acide isobutyrique |
Acide diméthylacétique; acide isopropylformique; acide 2-méthylpropanoïque; acide 2-méthylpropionique |
|
|
|
Acide isophtalique |
Acide benzène-1,3-dicarboxylique; acide m-benzènedicarboxylique; acide m-phtalique |
|
|
|
Acide lactique |
Acide DL-lactique |
|
|
|
Acide laurique |
Acide dodécanoïque; acide dodécylique; acide laurostéarique; acide n-undécanecarboxylique |
|
|
|
Acide maléique |
Acide cis-butènedioïque; acide cis-1,2-éthylènedicarboxylique; acide 1,2-éthylènedicarboxylique; acide toxilique |
|
|
|
Acide malonique |
Acide carboxyacétique; dicarboxyméthane; acide méthanedicarboxylique; acide propanedioïque |
|
|
|
Acide mandélique |
Acide α-hydroxyphénylacétique; acide α-hydroxytoluique; acide paramandélique; acide phénylglycolique; acide phénylhydroxyacétique |
|
|
|
Acide méthacrylique |
Acide méthacrylique; acide 2-méthylpropénoïque |
|
|
|
Acide nonanoïque |
Acide n-nonylique; acide 1-octanecarboxylique; acide pélargonique |
|
|
|
Acide 9-octadécénoïque |
Acide cis-9-octadécénoïque; acide 9,10-octadécénoïque; acide oléique |
|
|
|
Acide oxalique |
Acide éthanedioïque |
|
|
|
Acide palmitique |
Acide hexadécanoïque; acide hexadécylique; acide 1-pentadécanecarboxylique |
|
|
|
Acide phtalique |
Acide benzène-1,2-dicarboxylique; acide o-benzènedicarboxylique; |
|
|
|
Acide pivalique |
Acide 2,2-diméthylpropanoïque; acide α, α-diméthylpropionique; acide 2,2-diméthylpropionique; acide néopentanoïque; acide triméthylacétique |
|
|
|
Acide propionique |
Carboxyéthane; acide éthanecarboxylique; acide éthylformique; acide méthylacétique; acide propanoïque |
|
|
|
Acide salicylique |
Acide o-hydroxybenzoïque; acide 2-hydroxybenzoïque |
|
|
|
Acide stéarique |
Acide cétylacétique; acide 1-heptadécanecarboxylique; acide |
|
|
|
Acide succinique |
Acide butanedioïque; acide 1,2-éthanedicarboxylique |
|
|
|
Acide sulfanilique |
Acide p-aminobenzènesulfonique; acide 4-aminobenzènesulfonique; acide p-aminophénylsulfonique; acide aniline-p-sulfonique; acide aniline-4-sulfonique |
|
|
|
Acide tartrique |
Acide 2,3-dihydrosuccinique; acide 2,3-dihydroxybutanedioïque |
|
|
|
Acide téréphtalique |
Acide p-benzènedicarboxylique; acide 1,4-benzènedicarboxylique |
|
|
|
Acide p-toluènesulfonique |
Acide p-méthylbenzènesulfonique; acide 4-méthylbenzènesulfonique; |
|
|
|
Acide trichloracétique |
TCA |
|
|
|
Acide 2,4,5-trichlorophénoxyacétique |
Acide trichlorophénoxyacétique |
|
|
|
Acide trifluoracétique |
Acide trifluoréthanoïque; TFA |
|
|
|
Acide valérique |
Acide butanecarboxylique; acide 1-butanecarboxylique; acide pentanoïque; acide propylacétique |
|
|
|
Anhydride acétique |
UN1715 |
|
|
|
Anhydride maléique |
Anhydride cis-butènedioïque; 2,5-furanedione; anhydride de l’acide maléique; anhydride toxilique |
|
|
|
Anhydride phtalique |
Anhydride de l’acide benzène 1,2-dicarboxylique; 1,3-isobenzofuranedione; anhydride de l’acide phtalique |
|
|
|
Anhydride propionique |
Anhydride méthylacétique; anhydride propanoïque; anhydride de l’acide propionique |
|
|
|
Anhydride trimellitique |
Anhydride de l’acide 4-carboxyphtalique; acide 1,3-dioxo-5-phtalanecarboxylique; anhydride de l’acide 1,2,4-benzènetricarboxylique; anhydride trimellique; TMA |
|
|
|
Nom chimique et numéro CAS |
Fiches internationales de sécurité chimique (ICSC) |
NIOSH |
||||
|
Exposition de courte durée |
Exposition de longue durée |
Voies d’exposition |
Symptômes |
Organes cibles et voies de pénétration |
Symptômes |
|
|
Acide acétique |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Mal de gorge, toux, essoufflement, respiration laborieuse; les symptômes peuvent être retardés |
Voies respiratoires; peau; yeux; dents |
Irritation du nez, des yeux et de la gorge; brûlures oculaires et cutanées; dermatite; conjonctivite; toux; dépression du système nerveux central; œdème pulmonaire retardé; chez l’animal: reins; effets tératogènes et effets sur la reproduction |
|
Acide acétylsalicylique |
Yeux; peau; voies respiratoires |
Foie; reins; vessie; voies digestives; système cardio-vasculaire; système nerveux central; voies respiratoires |
Inhalation |
Toux, atonie |
Yeux; peau; voies respiratoires; sang; foie; reins |
Irritation des yeux, de la peau et des voies aériennes supérieures; temps de coagulation du sang plus long; nausées; vomissements; lésions hépatiques et rénales |
|
Acide acrylique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, écoulement nasal, respiration laborieuse, mal de gorge |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des voies respiratoires; brûlures oculaires et cutanées; sensibilisation de la peau; chez l’animal: lésions pulmonaires, hépatiques et rénales |
|
|
Acide adipique |
Yeux; peau; voies respiratoires |
Peau |
Inhalation |
Toux, respiration laborieuse, mal de gorge |
||
|
Acide L-ascorbique |
Yeux; voies respiratoires |
Inhalation |
Toux |
|||
|
Acide benzoïque |
Yeux; peau; voies respiratoires |
Peau |
Inhalation |
Toux, irritation |
||
|
Acide n-caproïque |
Yeux; peau; voies respiratoires |
Peau |
Inhalation |
Toux, mal de gorge |
||
|
Acide chloracétique |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse, mal de gorge; les symptômes peuvent être retardés |
||||
|
Acide 4-chloro-2-méthylphénoxyacétique |
Yeux; peau; voies respiratoires |
Malformations congénitales |
Inhalation |
Céphalées, nausées |
||
|
Acide citrique |
Yeux; peau; voies respiratoires |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse |
|||
|
Acide citrique, hydraté |
Yeux; voies respiratoires |
Inhalation |
Toux, mal de gorge |
|||
|
Acide crotonique |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Sensation de brûlure, toux, céphalées, nausées, essoufflement, mal de gorge; les symptômes peuvent être retardés |
||
|
Acide dichloracétique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, perte de conscience; les symptômes peuvent être retardés |
|||
|
Acide 2,4-dichlorophénoxyacétique |
Yeux; peau; voies respiratoires |
Inhalation |
Céphalées, nausées, faiblesse |
Peau; système nerveux central; foie; reins |
Faiblesse; stupeur; hyporéflexie; fasciculation; convulsions; dermatite; chez l’animal: lésions hépatiques et rénales |
|
|
Acide éthanedioïque, dihydraté |
Yeux; peau; voies respiratoires; poumons; reins |
Reins |
Inhalation |
Toux, essoufflement, mal de gorge |
||
|
Acide 2-éthylhexoïque |
Yeux; peau; voies respiratoires |
Foie |
Peau |
Rougeurs |
||
|
Acide fluoracétique |
Yeux; peau; voies respiratoires; système cardio-vasculaire; système nerveux central; reins |
|||||
|
Acide formique |
Yeux; peau; voies respiratoires; poumons |
Peau |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, essoufflement; les symptômes peuvent être retardés |
Yeux; peau; voies respiratoires; yeux |
Irritation des yeux, de la peau et de la gorge; brûlures cutanées; dermatite; larmoiement; rhinorrhée; toux; dyspnée; nausées |
|
Acide lactique |
Yeux; peau; voies respiratoires |
Inhalation |
Toux, essoufflement, mal de gorge; les symptômes peuvent être retardés |
|||
|
Acide maléique |
Yeux; peau; voies respiratoires |
Peau; reins |
Inhalation |
Toux, respiration laborieuse |
||
|
Acide méthacrylique |
Yeux; peau; muqueuses; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau et des muqueuses; brûlures oculaires et cutanées |
|
|
Acide oxalique |
Yeux; peau; voies respiratoires; poumons; reins |
Peau; reins |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, mal de gorge; les symptômes peuvent être retardés |
Voies respiratoires; peau, reins, yeux |
Irritation des yeux, de la peau et des muqueuses; brûlures oculaires; douleurs locales; cyanose; choc; collapsus; convulsions; lésions rénales |
|
Acide palmitique |
Yeux; peau; voies respiratoires; poumons |
Peau |
Yeux |
Rougeur |
||
|
Acide phtalique |
Yeux; peau; voies respiratoires |
Inhalation |
Toux |
|||
|
Acide propionique |
Yeux; peau; voies respiratoires |
Inhalation |
Toux, respiration laborieuse, mal de gorge |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau, du nez et de la gorge; troubles visuels; brûlures cutanées; douleurs abdominales; nausées; vomissements |
|
|
Acide salicylique |
Yeux; peau; voies respiratoires; système nerveux central |
Peau |
Inhalation |
Toux, mal de gorge |
||
|
Acide stéarique |
Yeux |
Poumons |
Inhalation |
Toux, respiration laborieuse |
||
|
Acide sulfanilique |
Yeux; peau; voies respiratoires; sang |
Peau; poumons |
Inhalation |
Cyanose labiale, unguéale ou cutanée, toux, étourdissements, céphalées, respiration laborieuse, mal de gorge |
||
|
Acide téréphtalique |
Yeux; peau |
Inhalation |
Toux, irritation |
|||
|
Acide p-toluènesulfonique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse |
|||
|
Acide 2,4,5-trichlorophénoxyacétique |
Yeux; peau; voies respiratoires |
Peau; foie; voies digestives |
Chez l’animal: ataxie; irritation cutanée; éruption acnéiforme; lésions hépatiques |
|||
|
Acide valérique |
Yeux; peau; voies respiratoires; poumons; système nerveux central |
|||||
|
Anhydride acétique |
Yeux; peau; voies respiratoires |
Peau |
Inhalation |
Corrosion, toux, respiration laborieuse, essoufflement, mal de gorge; les symptômes peuvent être retardés |
Voies respiratoires; peau; yeux |
Conjonctivite; larmoiement; œdème et opacité de la cornée; photophobie; irritation du nez et du pharynx; toux; dyspnée, bronchite; brûlures cutanées; vésiculation; dermatite |
|
Anhydride maléique |
Yeux; peau; voies respiratoires |
Peau |
Inhalation |
Toux, céphalées, respiration laborieuse, nausées, essoufflement, vomissements |
Yeux; voies respiratoires; peau |
Irritation du nez et des voies aériennes supérieures; conjonctivite; photophobie; diplopie; asthme; dermatite |
|
Anhydride phtalique |
Yeux; peau; voies respiratoires |
Peau; poumons |
Voies respiratoires; yeux; peau; foie; reins |
Irritation des yeux, de la peau et des voies aériennes supérieures; conjonctivite; ulcérations hémorragiques de la cloison nasale; bronchite; asthme; dermatite; chez l’animal: lésions hépatiques et rénales |
||
|
Anhydride propionique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, mal de gorge; les symptômes peuvent être retardés |
|||
|
Anhydride trimellitique |
Yeux; peau; voies respiratoires; poumons; sang |
Inhalation |
Toux, étourdissements, respiration sifflante, frissons |
Yeux; peau; voies respiratoires |
Irritation des yeux, de la peau, du nez et des voies respiratoires; œdème pulmonaire; sensibilisation respiratoire; respiration sifflante; rhinite; asthme; toux; dyspnée; fièvre; malaise; douleurs musculaires; éternuements |
|
|
Nom chimique et numéro CAS |
Risques physiques |
Risques chimiques |
Classification ONU/ risques subsidiaires |
|
Acide acétique |
Acide moyennement fort. Réagit violemment avec les oxydants comme le trioxyde de chrome et le permanganate de potassium. Réagit violemment avec les bases fortes. Attaque de nombreux métaux en formant un gaz combustible |
8 |
|
|
Acide acétylsalicylique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Se décompose au contact de l’eau chaude ou par dissolution dans des solutions d’hydroxydes alcalins ou de carbonates. Des vapeurs toxiques se forment sous l’effet de la chaleur. Réagit avec les oxydants énergiques, les acides forts, les bases fortes |
|
|
Acide acrylique |
Vapeur plus lourde que l’air. La vapeur forme un mélange explosif avec l’air |
Peut polymériser facilement sous l’effet de la chaleur ou sous l’influence de la lumière, de l’oxygène, des oxydants comme les peroxydes ou d’autres activateurs (acides, sels de fer), avec risque d’incendie et d’explosion. Des vapeurs toxiques se forment sous l’effet de la chaleur. Acide moyennement fort. Réagit violemment sur les oxydants avec risque d’incendie et d’explosion. Réagit violemment avec les bases fortes et les amines. Attaque de nombreux métaux, y compris le nickel et le cuivre |
8/3 |
|
Acide adipique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air. A sec, peut se charger électrostatiquement par brassage, transport pneumatique, transvasement, etc. |
Se décompose par chauffage, avec dégagement de vapeurs d’acide valérique et d’autres substances. Acide faible. Réagit avec les oxydants |
|
|
Acide L-ascorbique |
Acide moyennement fort en solution dans l’eau. Attaque de nombreux métaux en présence d’eau |
||
|
Acide benzoïque |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Acide faible en solution dans l’eau. Réagit avec les oxydants |
|
|
Acide butyrique |
8 |
||
|
Acide n-caproïque |
Peut exploser par échauffement. La combustion dégage des gaz toxiques et irritants. Acide moyennement fort. Réagit violemment sur les oxydants (trioxyde de chrome) avec risque d’incendie et d’explosion. Réagit énergiquement sur les bases avec risque d’incendie et d’explosion. Réagit énergiquement sur les bases avec risque d’élévation de la température et de la pression. Attaque de nombreux métaux pour former un gaz combustible |
8 |
|
|
Acide chloracétique |
Se décompose par chauffage, avec dégagement de gaz toxiques et corrosifs (chlorure d’hydrogène, phosgène). En solution dans l’eau, donne un acide fort qui réagit violemment avec les bases et qui est corrosif |
6.1/ 8 |
|
|
Acide 4-chloro-2-méthylphénoxyacétique |
Se décompose par chauffage, avec dégagement de vapeurs toxiques et corrosives contenant du chlorure d’hydrogène. Acide faible |
||
|
Acide citrique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Réagit avec les oxydants, les réducteurs, les bases |
|
|
Acide citrique, hydraté |
Acide moyennement fort en solution aqueuse. Réagit violemment avec les nitrates métalliques. Réagit avec les bases fortes et les oxydants. Corrode le cuivre, le zinc, l’aluminium et leurs alliages |
||
|
Acide crotonique |
Peut polymériser sous l’influence des ultraviolets ou de l’humidité. Acide faible en solution aqueuse. Réagit violemment sur les bases, les oxydants, les réducteurs avec risque d’incendie et d’explosion |
8 |
|
|
Acide dichloracétique |
Se décompose par chauffage, avec dégagement de vapeurs toxiques et corrosives (phosgène, chlorure d’hydrogène). Acide moyennement fort. Attaque de nombreux métaux pour former un gaz inflammable (hydrogène). Attaque le caoutchouc |
8 |
|
|
Acide 2,4-dichlorophénoxyacétique |
Se décompose par chauffage, avec dégagement de chlorure d’hydrogène et de phosgène. Acide faible. Réagit fortement sur les oxydants énergiques avec risque d’incendie et d’explosion |
||
|
Acide éthanedioïque, dihydraté |
Se décompose par chauffage rapide à plus de 150 °C, avec dégagement d’un gaz toxique. Acide moyennement fort en solution aqueuse. Réagit violemment avec les bases fortes. Réagit violemment sur les oxydants avec risque d’incendie et d’explosion. Réagit avec l’argent pour donner des produits explosifs |
||
|
Acide 2-éthylhexoïque |
Peut acquérir une charge électrostatique par agitation, écoulement, etc. La vapeur se mélange rapidement à l’air |
Réducteur énergique. Réagit sur les oxydants énergiques |
|
|
Acide fluoracétique |
6.1 |
||
|
Acide formique |
Se décompose par chauffage, avec dégagement de monoxyde de carbone. Acide moyennement fort. Réagit violemment avec les oxydants. Réagit violemment sur les bases fortes avec risque d’incendie et d’explosion. Attaque de nombreux métaux en présence d’eau. Attaque de nombreux plastiques |
8 |
|
|
Acide isobutyrique |
3/8 |
||
|
Acide lactique |
Acide moyennement fort. Attaque de nombreux métaux en présence d’eau |
||
|
Acide maléique |
La combustion dégage des vapeurs irritantes (anhydride maléique). Acide moyennement fort en solution aqueuse |
||
|
Acide méthacrylique |
Se polymérise facilement sous l’effet de la chaleur ou sous l’influence de la lumière, de l’oxygène, des oxydants comme les peroxydes, ou en présence de traces d’acide chlorhydrique avec risque d’incendie et d’explosion. Se décompose par chauffage, avec dégagement de fumées âcres. Réducteur énergique qui réagit sur les oxydants. Acide moyennement fort. Attaque les métaux |
8 |
|
|
Acide oxalique |
Se décompose au contact de surfaces chaudes ou de flammes pour donner de l’acide formique et du monoxyde de carbone. Réducteur énergique qui réagit sur les oxydants. Acide moyennement fort en solution aqueuse. Réagit violemment sur les oxydants énergiques avec risque d’incendie et d’explosion. Réagit sur certains composés de l’argent pour former de l’oxalate d’argent (explosif) |
||
|
Acide palmitique |
Forme des oxydes de carbone par chauffage. Acide faible. Réagit avec les bases, les oxydants et les réducteurs |
||
|
Acide phtalique |
Acide moyennement fort en solution aqueuse |
||
|
Acide propionique |
Acide moyennement fort. Réagit avec les oxydants. Attaque la plupart des métaux en présence d’eau |
8 |
|
|
Acide salicylique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Se décompose par chauffage, avec dégagement de vapeurs de phénol. Acide moyennement fort. Réagit violemment avec les bases fortes et les oxydants énergiques |
|
|
Acide stéarique |
Se décompose par chauffage, avec dégagement d’oxydes de carbone. Acide faible. Réagit avec les bases, les oxydants et les réducteurs |
||
|
Acide sulfanilique |
La combustion dégage des gaz toxiques (oxydes de carbone, oxydes d’azote, oxydes de soufre). Se décompose par chauffage. Réagit avec les oxydants |
||
|
Acide téréphtalique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air |
Réagit violemment avec les oxydants énergiques |
|
|
Acide p-toluènesulfonique |
Se décompose par combustion, avec dégagement d’oxydes de carbone et d’oxydes de soufre. Acide fort, qui réagit violemment avec les bases et qui est corrosif. Attaque de nombreux métaux en formant un gaz très inflammable |
||
|
Acide 2,4,5-trichlorophénoxyacétique |
6.1 |
||
|
Acide trifluoracétique |
8 |
||
|
Anhydride acétique |
Se décompose par chauffage, avec dégagement de vapeurs et de gaz toxiques comme l’acide acétique. Réagit violemment avec l’eau bouillante, la vapeur, les oxydants énergiques, les alcools, les amines, les bases fortes et beaucoup d’autres composés. Attaque de nombreux métaux en présence d’eau. Le liquide est très corrosif, surtout en présence d’eau ou d’humidité |
8/3 |
|
|
Anhydride maléique |
Acide fort en solution aqueuse, qui réagit violemment avec les bases et qui est corrosif. Réagit sur les oxydants énergiques |
8 |
|
|
Anhydride phtalique |
8 |
||
|
Anhydride propionique |
Vapeur plus lourde que l’air |
La combustion dégage des gaz toxiques. Réagit avec les oxydants, les bases et l’eau |
8 |
|
Anhydride trimellitique |
Possibilité d’explosion de poussières si sous forme de poudre ou de granulés mélangés à l’air. A sec, peut se charger électrostatiquement par brassage, transport pneumatique, transvasement, etc. |
Réagit violemment avec les oxydants. Réagit lentement avec l’eau pour former de l’acide trimellitique |
|
Nom chimique et numéro CAS |
Couleur/ aspect |
Point d’ébullition (ºC) |
Point de fusion (ºC) |
Masse moléculaire (g/mol) |
Solubilité dans l’eau |
Densité (eau = 1) |
Densité de vapeur (air = 1) |
Tension de vapeur (kPa) |
Limites d’explosibilité (%) |
Point d’éclair (ºC) |
Température d’auto- inflammation (ºC) |
|
Acide acétique |
Cristaux orthorhombiques (0,6 ºC point de fusion); liquide incolore (16,6 ºC point de fusion) |
116-118 |
16-17 |
60,05 |
Miscible |
1,04-1,05 |
2,07 |
1,46 |
4-19,9 |
39 cf |
427-516* |
|
Acide acétylsalicylique |
Cristaux monocliniques en tablettes ou en aiguilles |
>140 |
135 |
180,16 |
Soluble |
1,40 |
~0 |
||||
|
Acide acrylique |
Liquide incolore |
141 |
12-14 |
72,06 |
Miscible |
1,051-1,062 |
2,5 |
0,41 |
2,4-19,8* |
46-52 cf |
360*-438 |
|
Acide adipique |
Cristaux prismatiques monocliniques obtenus à partir de solutions dans l’acétate d’éthyle, l’eau ou l’acétone et l’éther de pétrole; cristaux fins ou poudre blancs |
337-338 |
152-153 |
146,14 |
Peu soluble |
1,360 |
5,04 |
10 Pa |
3,5-15 |
196 cf |
420-422 |
|
Acide L-ascorbique |
Cristaux monocliniques (généralement en paillettes, parfois en aiguilles); cristaux ou poudre de blanc à légèrement jaune |
190-192 |
176,13 |
Très soluble |
1,65 |
660* |
|||||
|
Acide benzoïque |
Cristaux monocliniques, en tablettes ou en paillettes; cristaux blancs en écailles ou en aiguilles |
249-250 |
122-123 |
122,12 |
Peu |
1,266 |
4,21 |
0,1 Pa |
121 cf |
570 |
|
|
Acide p-tertio-butyl benzoïque |
Aiguilles obtenues à partir de solutions alcooliques diluées |
164-165 |
178,23 |
Insoluble |
1,14 |
6,1 |
158* |
||||
|
Acide butyrique |
Liquide huileux; liquide incolore |
164 |
–7,9 à –5,7 |
88,11 |
Miscible |
0,958-0,959 |
3,04 |
57 Pa |
2,0-10,0 |
72 cf |
443-452 |
|
Acide n-caproïque |
Liquide huileux |
205 |
–3,4 à |
116,16 |
Peu soluble |
0,926-0,927 |
4,01 |
27 Pa |
1,3-9,3 |
102 co |
380 |
|
Acide chloracétique |
Cristaux prismatiques monocliniques; cristaux incolores ou blancs; cristaux d’incolore à brunâtre |
189-190 |
57-63 (γ) |
94,50 |
Très soluble |
1,40-1,58 |
3,26 |
8 Pa |
8,0-? |
126 cf |
>500* |
|
Acide chlorendique |
Solide cristallin |
260* |
208-242* |
388,85 |
Peu soluble |
0,95-0,99 |
|||||
|
Acide 4-chloro-2-méthylphénoxyacétique |
Solide brun clair; plaquettes obtenues à partir de solutions dans le benzène ou le toluène; solide blanc cristallin (substance pure); solide cristallin incolore (pur) |
120 |
200,62 |
Peu soluble |
1,56 |
6,92 |
~0 |
||||
|
Acide m-chlorobenzoïque |
Cristaux; cristaux prismatiques obtenus à partir de solutions dans l’eau |
(sublimation) |
142-158 |
156,57 |
Peu soluble |
1,496 |
~0 |
||||
|
Acide o-chlorobenzoïque |
Cristaux prismatiques monocliniques obtenus à partir de solutions dans l’eau |
(sublimation) |
140-142 |
156,57 |
Soluble |
1,544 |
~0 |
173* |
530* |
||
|
Acide p-chlorobenzoïque |
Cristaux prismatiques tricliniques obtenus à partir de solutions dans l’alcool et l’éther; poudre grossière presque blanche |
243 |
156,57 |
Insoluble |
~0 |
238 cf |
545 |
||||
|
Acide 2-chloropropionique |
Cristaux |
185-186 |
–12* |
108,52 |
Miscible |
1,286 |
3,8 |
0,14 |
101-107 |
500 |
|
|
Acide citrique |
Cristaux/ holoèdres/ monocliniques/ cristallisation obtenue à partir de solutions aqueuses chaudes concentrées; cristaux incolores, transparents ou blancs, poudre cristalline, de granuleuse à fine/cristaux orthorombiques obtenus à partir de solutions aqueuses avec 1 mol d’eau de cristallisation |
(décomposition) |
153 |
192,13 |
Très soluble |
1,665 |
0,3-2,3 |
100 |
1000-1020 |
||
|
Acide citrique, hydraté |
Cristaux |
175* (décomposition) |
210,14 |
Soluble |
1,54 |
1010 |
|||||
|
Acide crotonique |
Cristaux monocliniques prismatiques ou en aiguilles (obtenus à partir de solutions dans l’eau ou l’éther de pétrole); cristaux en aiguilles incolores; solide blanc cristallin |
185-189 |
71-72 |
86,09 |
Soluble |
1,02 |
2,97 |
19 Pa |
2,2-15,1 |
88 co |
396 |
|
Acide dichloracétique |
Liquide incolore |
193-194 |
10-14 |
128,94 |
Miscible |
1,563 |
4,45 |
19 Pa |
113* |
||
|
Acide 2,4-dichlorophénoxyacétique |
Poudre cristalline de blanc à jaune; la couleur jaune signale des impuretés phénoliques; poudre incolore; blanc |
160 sous 53 Pa |
138-141 |
221,04 |
Peu soluble |
1,56 |
7,63 |
53 Pa à 160 ºC |
88 co |
||
|
Acide 2,4-dichlorophénoxyproprionique |
Solide cristallin incolore; de blanc à brun, solide cristallin |
117-118 |
235,07 |
Peu soluble |
1,42* |
||||||
|
Acide 2-diméthylamino- éthyl-méthacrylique |
Liquide |
182-192* |
–30* |
157,21 |
Soluble |
0,933 |
5,4 |
<0,13 |
1,2-? |
64 cf |
|
|
Acide éthanedioïque, dihydraté |
Cristaux incolores |
149-160 (sublimation) |
101-102 |
126,07 |
Soluble |
1,65 |
4,3-4,4 |
<1 Pa |
|||
|
Acide 2-éthylhexoïque |
Liquide incolore |
228-229 |
–59* |
144,21 |
Soluble |
0,903 |
4,98 |
4 Pa |
0,8-8,6 |
114 co |
310*-371 |
|
Acide fluoracétique |
Aiguilles; cristaux incolores |
165-168 |
33-35 |
78,04 |
Soluble |
1,369 |
0,25 |
||||
|
Acide formique |
Liquide incolore |
101 |
8,3-8,4 |
46,03 |
Miscible |
1,220 |
1,59 |
4,4 |
14,3-57 |
46 cf |
434-480 |
|
Acide fumarique |
Cristaux aciculaires, prismatiques monocliniques ou en feuillets obtenus à partir de solutions aqueuses; cristaux incolores; poudre blanche cristalline |
165 (sublimation) |
287 (décomposition) |
116,07 |
Peu soluble |
1,625-1,635 |
3-40 |
230* |
740 |
||
|
Acide gallique |
Cristaux prismatiques obtenus à partir de solutions aqueuses; cristaux aciculaires obtenus à partir de solutions dans le méthanol absolu ou le chloroforme |
253-265 (décomposition) |
170,12 |
Peu soluble |
1,694 |
>93 cf |
|||||
|
Acide glycolique |
Cristaux incolores; aiguilles orthorhombiques obtenues à partir de solutions aqueuses; feuillets obtenus à partir de solutions éthanoliques |
100 |
79-80 |
76,05 |
Soluble |
1,27* |
|||||
|
Acide heptanoïque |
Liquide huileux limpide |
222,2 |
–7,5 |
130,19 |
Peu soluble |
0,918 |
4,5 |
1,3 Pa |
1,1-10,1 |
>110 cf |
|
|
Acide isobutyrique |
Liquide incolore |
152-155 |
–47 à |
88,11 |
Très soluble |
0,950-0,968 |
3,0-3,4 |
0,13 |
2,0-9,2 |
55 co |
481 |
|
Acide isophtalique |
Aiguilles |
(sublimation) |
347-348 |
166,13 |
Peu soluble |
1,54 |
5,73 |
168* |
650* |
||
|
Acide lactique |
Liquide incolore ou cristaux incolores |
122 |
17-18 |
90,08 |
Très soluble |
1,206 |
>74* |
||||
|
Acide laurique |
Solide incolore; poudre cristalline blanche |
91* |
43-48 |
200,32 |
Peu soluble |
0,868 |
0,13 à 121 ºC |
>110 cf |
|||
|
Acide maléique |
Cristaux prismatiques monocliniques obtenus à partir de solutions aqueuses; cristaux blancs obtenus à partir de solutions aqueuses, alcooliques ou benzéniques; cristaux incolores |
130-139 |
116,07 |
Très soluble |
1,590 |
4,0 |
<10 Pa |
||||
|
Acide malonique |
Cristaux blancs |
(sublimation) |
135-136 |
104,06 |
Très soluble |
1,62-1,63 |
3,6 |
172* |
|||
|
Acide méthacrylique |
Liquide ou cristaux incolores; liquide incolore |
162-163 |
16 |
86,09 |
Soluble |
1,015 |
2,97 |
0,09-0,13 |
1,6-8,8 |
68 cf |
68* |
|
Acide nonanoïque |
Liquide huileux incolore à température normale; cristallise en refroidissant; huile jaunâtre |
252-255 |
12-13 |
158,24 |
Peu soluble |
0,905-0,907 |
5,4-5,5 |
<13 Pa |
0,8-9,0 |
100 cf |
405 |
|
Acide 9-octadécénoïque |
Liquide incolore ou presque (au-dessus de 5-7 ºC); liquide huileux jaunâtre |
286 sous 13,3 kPa |
13-16 |
282,47 |
Peu soluble |
0,893 |
0,13 à 176 °C |
189 cf |
363 |
||
|
Acide oxalique |
Acide oxalique anhydre, cristallisé à partir de solutions d’acide acétique glacial donne des cristaux pyramidaux ou octaédriques orthorhombiques allongés; cristaux incolores, transparents ou poudre blanche |
150-157 (sublimation) |
189 |
90,04 |
Soluble |
1,653 |
4,4 |
<0,13 Pa |
|||
|
Acide palmitique |
Ecailles blanches cristallines; aiguilles obtenues à partir de solutions alcooliques |
350-352 |
63-64 |
256,43 |
Peu soluble |
0,853 à 62 ºC |
0,13 à 154 ºC |
>121 |
|||
|
Acide phtalique |
Cristaux; plaquettes obtenues à partir de solutions aqueuses |
230 (décomposition) |
166,13 |
Peu soluble |
2,18 à 191 °C |
5,73 |
168 cf |
||||
|
Acide pivalique |
Cristaux colorés |
163-164 |
35-36 |
102,13 |
Peu soluble |
0,905 à 50 ºC |
3,52 |
1,33 à 60 °C |
46 cf |
||
|
Acide propionique |
Liquide incolore; liquide huileux |
141 |
–21 à –20 |
74,08 |
Miscible |
0,993 |
2,56 |
0,32-0,40 |
2,1-14,8 |
52 cf |
465 |
|
Acide salicylique |
Cristaux aciculaires blancs, fins ou poudre cristalline blanche ou floconneuse; aiguilles par cristallisation obtenues à partir de solutions aqueuses; prismes monocliniques par cristallisation obtenus à partir de solutions alcooliques |
211 sous 2,66 kPa |
158-159 |
138,12 |
Peu soluble |
1,443 |
4,8 |
0,13 à 114 °C |
1,1-? |
156 cf |
540 |
|
Acide stéarique |
Cristaux monocliniques en feuillets obtenus à partir de solutions alcooliques; masse cristalline ou poudre blanche ou légèrement jaune |
350-383 (décomposition) |
69-70 |
284,48 |
Peu soluble |
0,941 |
9,80 |
0,13 à 174 ºC |
196 cf |
395 |
|
|
Acide succinique |
Petits cristaux prismatiques monocliniques blancs; cristaux tricliniques ou monocliniques |
235 (décomposition) |
185-188 |
118,09 |
Peu soluble |
1,572 |
|||||
|
Acide sulfanilique |
Plaquettes orthorhombiques ou cristaux monocliniques obtenus à partir de solutions aqueuses |
288 |
173,19 |
Peu soluble |
1,485 |
||||||
|
Acide tartrique |
168-170 |
150,09 |
Très soluble |
1,67-1,76 |
5,18 |
150 cf |
425 |
||||
|
Acide téréphtalique |
Aiguilles; cristaux ou poudre blancs |
300 (sublimation) |
166,13 |
Insoluble |
1,51-1,52 |
5,74 |
<1 Pa |
260 co |
496 |
||
|
Acide p-toluènesulfonique |
Cristaux monocliniques prismatiques ou en feuillets; cristaux incolores |
140 sous 2,66 kPa |
104-107 |
172,20 |
Très soluble |
1,24* |
6,0 |
3,59 à 140 °C |
184 cf |
||
|
Acide trichloracétique |
Cristaux; incolore; solide blanc |
196-197 |
57-58 |
163,39 |
Très soluble |
1,62 |
0,17 à 51,0 ºC |
113* |
|||
|
Acide 2,4,5-trichlorophénoxyacétique |
Solide blanc; solide brun clair |
153 |
255,48 |
Peu soluble |
1,80 |
<1 Pa |
|||||
|
Acide trifluoracétique |
Incolore; liquide fumant |
72-73 |
–15 |
114,02 |
Soluble |
1,535 |
3,9-4,0 |
12,90 |
|||
|
Acide valérique |
Liquide incolore |
186-187 |
–35 à –34 |
102,13 |
Soluble |
0,939 |
3,52 |
20 Pa |
1,6-7,6 |
86 cf |
360-400 |
|
Anhydride acétique |
Liquide incolore, très mobile et très réfringent |
139-140 |
–73 |
102,09 |
Soluble |
1,081-1,082 |
3,52 |
0,5 |
2,7-10,3 |
49 cf |
316*-392 |
|
Anhydride maléique |
Aiguilles orthorhombiques obtenues à partir de solutions de chloroforme; anhydride maléique fondu de qualité commerciale en briquettes; aiguilles incolores, blocs blancs ou boulettes; aiguilles obtenues à partir de solutions de chloroforme ou d’éther |
202 |
52-53 |
98,06 |
Soluble |
1,31-148 |
3,4 |
25 Pa |
1,4-7,1 |
102 cf |
421*-477 |
|
Anhydride phtalique |
Aiguilles brillantes, blanches; paillettes solides, jaune pâle ou incolores; aiguilles incolores; cristaux prismatiques monocliniques ou orthorhombiques; aiguilles blanches obtenues à partir de solutions alcooliques ou benzéniques |
285-295 (sublimation) |
131 |
148,12 |
Peu soluble |
1,527 à 4 °C |
5,10 |
0,1 |
1,7-10,5 |
151 cf |
570-584 |
|
Anhydride propionique |
Liquide incolore |
167-170 sous 9,47 kPa |
–45 à –43 |
130,14 |
Réaction |
1,011-1,012 |
4,49 |
0,12 |
1,3-11,9 |
63 cf |
284-285 |
|
Anhydride trimellitique |
Cristaux; solide incolore |
390 |
162-169 |
192,13 |
Réaction |
1,54 |
6,6 |
~0 |
1-7 |
227* co |