

L’appareil rénal et urinaire est constitué d’un ensemble complexe d’organes qui ont pour fonction de filtrer les résidus du sang et de former, de stocker et d’excréter l’urine. Ces organes sont essentiels au maintien de l’homéostasie par le contrôle de l’équilibre hydrique, de l’équilibre acido-basique et de la pression artérielle. Les principaux organes de ce système sont les deux reins et la vessie. Au cours du processus de filtration des déchets du sang, les reins peuvent être exposés à des concentrations élevées de substances toxiques d’origine endogène et exogène. Certaines cellules rénales sont ainsi exposées à des concentrations mille fois plus élevées que les concentrations sanguines.
Les conséquences des facteurs nocifs sur la fonction rénale sont dites prérénales lorsque la vascularisation du rein est compromise, rénales quand le rein lui-même est affecté, ou postrénales lorsqu’il y a lésion des voies excrétrices empruntées par l’urine entre le rein et l’extrémité de l’urètre. Les problèmes postrénaux sont généralement de type obstructif. La prostate est souvent le siège d’une obstruction du fait de sa position entre la vessie et l’urètre terminal. Une pathologie préexistante de la prostate, de la vessie ou des uretères, en particulier une infection, une obstruction par des corps étrangers, tels que les lithiases, peuvent compromettre la fonction rénale et augmenter la vulnérabilité aux anomalies acquises ou congénitales.
Il est important de comprendre la microanatomie et les mécanismes d’échanges moléculaires qui interviennent dans le système rénal et urinaire pour évaluer la sensibilité aux expositions pro-fessionnelles et en assurer la surveillance et la prévention. Les substances toxiques semblent s’attaquer préférentiellement à certains sites spécifiques des reins ou de la vessie, ce qui se traduit par la libération de marqueurs biologiques propres au segment atteint. Traditionnellement, l’étude des prédispositions aux maladies s’est faite dans une perspective épidémiologique d’identification des travailleurs à risque. Aujourd’hui, grâce à une meilleure compréhension des mécanismes physiopathologiques, l’évaluation du risque individuel au moyen de marqueurs biologiques de susceptibilité, d’exposition, d’effet et de maladie est devenue possible. L’élaboration de stratégies pour protéger les travailleurs contre les risques professionnels se heurte cependant à de nouvelles questions d’éthique dues à la nécessité de tenir compte du rapport coût-efficacité des mesures préventives. Les progrès réalisés dans le domaine des tests génétiques pour évaluer la prédisposition aux maladies et dans celui des indicateurs biologiques d’exposition et d’effet permettent de savoir où et à quel moment l’intervention peut être le plus bénéfique. Ce chapitre présente une description du système rénal et urinaire qui pourra servir de base à des recommandations sur l’évaluation et la réduction des risques professionnels tout en tenant compte des questions d’éthique associées.
Le rein humain est un organe complexe qui filtre les résidus du sang grâce à la production d’urine. Les reins assurent également plusieurs autres fonctions vitales, notamment le maintien de l’homéostasie, la régulation de la pression artérielle et de la pression osmotique, ainsi que l’équilibre acido-basique. Le rein reçoit 25% du débit sanguin cardiaque, ce qui le rend vulnérable aux toxines endogènes et exogènes.
Les reins sont situés de chaque côté de la colonne vertébrale dans la région lombaire. Chacun des deux reins pèse environ 150 g et a environ 12 cm de hauteur pour 6 cm de largeur. On observe deux zones: une zone externe, le cortex, et une zone plus profonde, la médullaire du rein. Le bassinet est la cavité bordée de tissu rénal qui prend naissance au bord concave du rein et se prolonge par l’urètre. Le sang parvient au cortex et à la médullaire par les branches de l’artère rénale et ses subdivisions successives. Chaque artériole se termine au niveau d’une unité de filtration, le néphron. Un rein sain contient environ 1,2 million de néphrons répartis de façon stratégique entre le cortex et la médullaire.
Tout néphron comporte un glomérule, c’est-à-dire un peloton capillaire «englobé» par une capsule en deux couches, la capsule de Bowman, dont la lumière s’ouvre dans le tube contourné proximal. La portion fluide du sang, le plasma, est «forcée» dans la capsule de Bowman, puis le filtrat glomérulaire passe dans le tube contourné proximal. Environ 99% de l’eau et des nutriments essentiels filtrés (acides aminés, glucose) sont réabsorbés par les cellules tubulaires et passent dans les capillaires qui entourent le tube contourné proximal. Au niveau du glomérule, le sang non filtré est également évacué par des capillaires, puis par la veine rénale avant de retourner vers le cœur.
Les néphrons ont l’aspect de longs conduits à boucles multiples comprenant plusieurs segments dont chacun est responsable de diverses fonctions qui, toutes, contribuent à l’homéostasie de l’organisme. La Figure 8.1 montre un néphron dans ses rapports avec le cortex et la médullaire du rein. Chaque segment tubulaire reçoit un apport sanguin différent qui régule le gradient ionique. Certaines substances chimiques exercent des effets toxiques aigus ou chroniques sur des segments tubulaires spécifiques et dont la gravité dépend du type d’exposition et de la dose de substance xénobiotique. Selon le segment de la microanatomie du néphron touché, différents aspects de la fonction rénale peuvent être affectés.
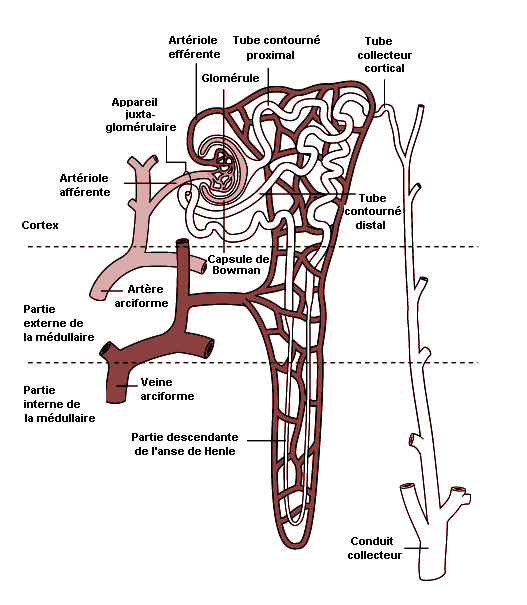
Les vaisseaux du rein ne vascularisent que les éléments glomérulaires et tubulaires. Ils apportent les résidus à filtrer, recyclent les nutriments, les protéines et les électrolytes et fournissent l’oxygène nécessaire à la vie de l’organe. Le cortex reçoit 90% du flux sanguin, cette proportion diminuant en direction de la médullaire. Ce contraste marqué d’apport sanguin et l’orientation des unités de filtration sont essentiels au mécanisme à contre-courant grâce auquel l’urine est concentrée et se charge des déchets et substances potentiellement toxiques pour le rein.
Le glomérule comporte un pôle vasculaire par où arrive l’artériole afférente et un pôle d’où sort l’artériole efférente. Les artérioles efférentes donnent naissance à un réseau de capillaires péritubulaires, à l’exception du tube contourné distal qui, lui, jouxte l’artériole afférente du glomérule. Les tubes proximaux et distaux, innervés par les terminaisons nerveuses sympathiques, répondent à la stimulation du système nerveux autonome et à des médiateurs hormonaux, tels que la vasopressine (hormone antidiurétique (ADH)). La macula densa, qui fait partie de l’appareil juxtaglomérulaire du rein, produit la rénine, médiateur de la pression artérielle, en réponse aux variations de la pression osmotique et de la pression artérielle. La rénine agit sur l’angiotensinogène pour donner l’angiotensine I. Sous l’effet d’une enzyme hépatique, l’angiotensine I se transforme en un octopeptide, l’angiotensine II, agent hypertenseur très actif qui agit notamment par le biais d’une constriction des artérioles glomérulaires et d’une production accrue d’aldostérone.
Le filtre glomérulaire permet uniquement le passage des protéines d’un certain poids moléculaire et d’une certaine charge électrostatique. La filtration du plasma est régulée par l’équilibre entre les pressions osmotique et hydrostatique. Des glycosaminoglycanes (mucopolysaccharides) chargés négativement inhibent par répulsion électrostatique la filtration des substances anioniques. La membrane basale glomérulaire comprend plusieurs couches dont trois importantes: un endothélium fenestré, la membrane basale proprement dite et un épithélium pavimenteux constitué de pédicelles imbriqués qui ménagent les pertuis au travers desquels passe le filtrat. En cas de lésion de cette membrane basale spécialisée, ou de l’endothélium capillaire, l’albumine (protéine de poids moléculaire élevé) peut se répandre en quantités anormalement élevées dans l’urine. La présence d’un excès d’albumine ou d’autres macroprotéines dans l’urine est un indice de lésion glomérulaire ou tubulaire.
Entourant chaque tube et chaque glomérule, il existe dans le rein une petite quantité de tissu conjonctif que l’on appelle l’interstitium rénal. L’interstitium est très discret dans la corticale du rein et plus important dans la médullaire. Avec le vieillissement de l’individu, la proportion de cellules interstitielles dans le cortex augmente de concert avec l’apparition de fibrose et de tissu cicatriciel. Les cellules de l’interstitium contiennent des gouttelettes lipidiques et peuvent agir sur le contrôle de la pres-sion artérielle par la libération d’agents vasoconstricteurs ou vasodilatateurs. Un certain nombre de glomérulopathies peuvent être compliquées de lésions tubulaires et interstitielles, et inverse-ment. De ce fait, en cas d’insuffisance rénale dépassée, il est quelquefois difficile de définir précisément le mécanisme pathogénique impliqué.
Les tubes proximaux réabsorbent 80% du sodium, de l’eau et du chlore, ainsi que 100% de l’urée. La partie terminale des tubes proximaux (segment P3) est la plus vulnérable aux substances xénobiotiques néphrotoxiques. Lorsque les cellules proximales sont lésées par des métaux lourds, tels que le chrome, la capacité du rein de concentrer les urines est altérée et l’urine est anormalement diluée. En cas de toxicité dirigée contre le segment P3, on assiste à la libération dans l’urine d’enzymes, telles que la phosphatase alcaline intestinale, la N-acétyl-beta-D-glucosaminidase (NAG) ou la protéine de Tamm-Horsfall.
La créatinine (Cr) est une autre substance qui passe au travers du glomérule, mais qui n’est que très peu réabsorbée par les tubes proximaux. Lors de l’insuffisance rénale, les reins perdent leur capacité d’éliminer les toxines produites par l’organisme et la créatinine sérique augmente. Etant donné que cette substance provient du catabolisme musculaire et dépend de la masse maigre du patient, la sensibilité et la spécificité de ce paramètre pour mesurer la fonction rénale sont faibles. On utilise néanmoins les mesures de créatinine pour des raisons pratiques. Un test plus sensible et plus spécifique de la capacité d’épuration plasmatique du rein consiste à calculer la clairance de la créatinine (ClCr) qui s’obtient par la formule générale ClCr= UCr V/PCr où UCr V est la quantité de créatinine excrétée par unité de temps, et PCr la concentration plasmatique en créatinine. Cependant, la clairance de la créatinine est difficile à mesurer, car elle nécessite le recueil des urines de vingt-quatre heures. Cette méthode n’est donc pas commode pour les tests en milieu professionnel. Les tests de clairance de substances marquées par des isotopes radioactifs, comme l’iodohippurate, dont l’excrétion est presque exclusivement rénale, sont une autre possibilité mais, outre leur coût élevé, ils posent eux aussi des problèmes pratiques si l’on veut les réaliser en milieu de travail. Une comparaison de la fonction rénale des deux reins peut être faite par double scintigraphie rénale isotopique ou par cathétérisme sélectif des deux reins, via l’uretère. Il est clair que ces méthodes ne peuvent pas être employées pour des tests à grande échelle en milieu professionnel. Etant donné qu’une perte de fonction rénale allant jusqu’à 70 à 80% peut s’installer avant toute élévation de la créatinine sérique et que les autres tests existants sont difficiles à pratiquer ou trop coûteux, il est nécessaire de recourir à des marqueurs biologiques non invasifs pour déceler les effets sur les reins d’expositions intermittentes à de faibles doses d’agents néphrotoxiques. La partie ci-après sur les marqueurs biologiques étudie de manière détaillée un certain nombre de substances permettant de déceler les lésions rénales dues à des faibles doses de toxiques ou les modifications précancéreuses du tractus urinaire.
Les cellules du tube proximal réabsorbent 80% des liquides, mais c’est au mécanisme de «contre-courant» et aux tubes distaux que revient la régulation fine des quantités de liquides à réabsorber, par le biais de l’hormone antidiurétique (ADH). Cette hormone est sécrétée par l’hypophyse qui est située à la base du cerveau et les quantités d’ADH libérées dans la circulation sont fonction de la pression osmotique et de la volémie. Des substances exogènes, telles que le lithium, peuvent léser les tubes distaux et causer un diabète insipide rénal (urine excessivement diluée). Le diabète insipide peut également être d’origine héréditaire. Les substances xénobiotiques affectent généralement les deux reins, mais l’interprétation devient complexe lorsque l’exposition à ces produits est difficile à objectiver ou en cas de maladie rénale préexistante. Par conséquent, c’est souvent à la suite d’expositions accidentelles à des doses élevées que l’on a pu identifier les substances néphrotoxiques. La majorité des expositions à des substances toxiques pour les reins, sur le lieu de travail, concernent de faibles doses et passent inaperçues en raison de la réserve du capital de filtration du rein et de sa capacité compensatoire (hypertrophie réactionnelle). A ce jour, les méthodes cliniques ne permettent toujours pas de déceler les expositions à de faibles doses.
La vessie est un organe creux qui sert à entreposer l’urine. Normalement, elle se contracte de façon volontaire pour permettre la miction par l’intermédiaire de l’urètre. La vessie est située dans la partie antérieure et inférieure de la région pelvienne. Elle est flanquée de part et d’autre, par abouchement, de deux tubes musculeux parcourus de contractions péristaltiques, les uretères, qui transportent l’urine des reins vers la vessie. La lumière des bassinets, des uretères et de la vessie est tapissée par l’urothélium qui est un épithélium de transition. La couche externe de l’urothélium est faite de cellules «parapluie» recouvertes d’une couche de mucopolysaccharides. Les cellules de l’urothélium sont disposées en couches successives jusqu’à la membrane basale de la vessie. Ainsi, les cellules profondes sont protégées par les cellules plus superficielles. Toutefois, si la couche protectrice de mucopolysaccharides est endommagée, les cellules basales deviennent vulnérables aux substances présentes dans l’urine. L’architecture cellulaire de l’épithélium transitionnel lui permet tour à tour de se dilater ou de se contracter, et la desquamation normale des cellules urothéliales ne nuit pas à l’intégrité des cellules basales.
La régulation neurophysiologique qui équilibre le stockage de l’urine et la miction peut subir les effets néfastes de chocs électriques ou d’autres traumatismes, notamment des lésions de la moelle épinière qui peuvent survenir sur le lieu de travail. Nombre de quadriplégiques décèdent suite à la perte du contrôle vésical qui se complique de lésions rénales chroniques par infections et lithiases. Il n’est pas rare d’observer des infections chroniques dues à une vidange incomplète de la vessie, d’origine neurologique ou obstructive (par exemple, fracture du bassin ou autres traumatismes de l’urètre avec sténose résiduelle). Une vulnérabilité particulière à des substances exogènes sur le lieu de travail peut être à l’origine d’infections chroniques par des bactéries ou de lithiases responsables de pathologies inflammatoires chroniques et malignes de la vessie.
Etant donné que de nombreuses altérations biochimiques surviennent lors de la cancérogenèse, les molécules libérées par les lésions et les processus de réparation de la vessie peuvent servir de marqueurs intermédiaires pour des maladies toxiques ou malignes. Les cellules de la vessie, comme celles du rein, sont dotées de systèmes enzymatiques actifs, tels que le cytochrome P-450, capable d’activer ou d’inactiver les substances xénobiotiques. Le degré d’activité des enzymes est déterminé par l’hérédité et fait montre de polymorphisme génétique. L’urine évacuée contient des cellules provenant de l’exfoliation de l’épithélium transitionnel des reins, des uretères, de la vessie, de l’urètre prostatique et de l’urètre. Les altérations de ces cellules, survenues dans le cadre des pathologies du rein et de la vessie, peuvent être détectées grâce à des marqueurs biologiques. D’après Virchow, toutes les maladies commencent dans les cellules. Cela doit inciter à donner à ces dernières toute l’importance qui leur revient, car elles sont le «miroir moléculaire» de l’exposition aux substances xénobiotiques nocives.
Un nombre important de données épidémiologiques tendent à confirmer la relation de cause à effet entre l’exposition professionnelle à des substances toxiques et le cancer de la vessie, mais le rôle précis de ces expositions dans l’insuffisance rénale et le cancer du rein est difficile à évaluer. Il a été estimé que jusqu’à 10% des cas d’insuffisance rénale dépassée peuvent être attribués à des expositions professionnelles, mais ces résultats sont difficiles à valider étant donné que les expositions aux nuisances chimiques ou environnementales varient sans cesse, que les critères de diagnostic ne sont pas homogènes et que le temps de latence entre l’exposition et l’apparition de la maladie est souvent long. Selon les estimations, jusqu’à deux tiers des néphrons des deux reins peuvent avoir cessé d’assumer leur fonction avant que la perte du pouvoir d’épuration rénale ne devienne cliniquement décelable. Cependant, des observations concordantes semblent indiquer que des facteurs de néphrotoxicité antérieurement considérés comme socio-économiques ou ethniques pourraient être liés à l’environnement, ce qui renforce l’hypothèse selon laquelle les produits toxiques jouent un rôle dans la pathogenèse de l’insuffisance rénale.
La néphrotoxicité peut être imputable directement aux substances xénobiotiques, mais ces dernières peuvent aussi subir une activation ou une inactivation, en une ou en plusieurs étapes, au niveau du rein ou du foie. L’activation des substances xénobiotiques est régulée par un ensemble complexe d’enzymes de phase I, de phase II ou d’enzymes accessoires. L’un des principaux systèmes enzymatiques de phase I est constitué par le cytochrome P-450 qui agit par des réactions d’oxydation et de réduction. Les enzymes de phase II catalysent la conjugaison, tandis que les enzymes accessoires régulent le métabolisme des médicaments (le tableau 8.1 donne la liste de ces enzymes). Divers modèles animaux ont fait avancer les connaissances sur les mécanismes métaboliques. L’analyse au microscope de coupes de reins, ainsi que la microdissection de néphrons en culture tissulaire permettent de mieux comprendre les mécanismes pathologiques. Cependant, les variations entre individus et entre espèces sont considérables et, bien que les mécanismes puissent être similaires, la prudence est de rigueur si on veut extrapoler les résultats aux travailleurs. La priorité est donnée à l’identification des substances xénobiotiques néphrotoxiques ou cancérogènes, à la détermination des cibles de ces produits et à la mise au point de méthodes pour mieux dépister les toxicités subcliniques pour le système rénal et urinaire.
|
ENZYMES |
||
|
Phase I |
Phase II |
Auxiliaires |
|
Cytochrome P-450 |
Estérase |
GSH peroxydase |
|
Mono-oxygénase microsomale à FAD |
N-Acétyltransférase |
GSSG réductase |
|
Alcool et aldéhydes déshydrogénases |
GSH S-transférase |
Superoxyde dismutase |
|
Epoxyde hydrolase |
Thiol S-méthyltransférase |
Catalase |
|
Prostaglandine synthétase |
UDP glucuronosyltransférase |
DT-diaphorase |
|
Monoamine-oxydase |
Sulfotransférase |
Voies de régénération de NADPH |
1 Les enzymes de phase I catalysent des réactions d’oxydation, de réduction ou d’hydrolyse. Les enzymes de phase II catalysent généralement la conjugaison. Les enzymes auxiliaires agissent de façon secondaire ou accessoire pour faciliter le métabolisme des médicaments.
Source: National Research Council, 1995.
Les glomérulonéphrites sont des maladies inflammatoires réactionnelles de la membrane basale glomérulaire et de l’endothélium capillaire. La maladie peut prendre une forme aiguë ou chronique et les causes sont diverses: maladies infectieuses, auto-immunes ou inflammatoires, ou expositions à des substances toxiques. Les glomérulonéphrites s’accompagnent d’une vasculite systémique ou limitée aux reins. En cas de néphrotoxicité intense dirigée contre l’interstitium, des lésions secondaires et chroniques des glomérules surviennent également. La présence à l’examen microscopique de croissants épithélio-glomérulaires ou de formes prolifératives signe la glomérulonéphrite dans les biopsies de reins. Les symptômes de glomérulonéphrite sont la présence de sang, de cylindres hématiques (globules rouges) ou de protéines dans les urines, associée à de l’hypertension artérielle. Des modifications des protéines sanguines peuvent apparaître, notamment une baisse de certaines fractions du complément sérique. Celui-ci est un ensemble complexe de protéines qui interagissent et interviennent dans le système immunitaire, la défense de l’hôte et la coagulation. Des observations directes et indirectes confirment l’importance des substances xénobiotiques en tant que facteurs causals dans l’apparition de certaines glomérulonéphrites.
Le glomérule empêche les globules rouges du sang transporteurs d’oxygène de passer au travers de son filtre. Après centrifugation, lorsqu’on examine l’urine normale au fort grossissement microscopique, on ne décèle qu’un globule rouge par 10 ml. Lorsque les globules rouges passent au travers du filtre glomérulaire et deviennent éventuellement dysmorphiques, on assiste à la formation de cylindres hématiques qui sont moulés sur la forme cylindrique des tubes collecteurs.
La responsabilité des produits toxiques en tant que facteurs étiologiques des maladies glomérulaires est confirmée par des études épidémiologiques qui révèlent des expositions à ce type de produits chez des patients dialysés ou atteints de glomérulonéphrite. Il est rare de trouver des signes de lésions glomérulaires consécutives à une exposition aiguë à un hydrocarbure, bien que des études épidémiologiques en aient déjà signalé avec un rapport de cotes (odds ratio (OR)) compris entre 2,0 et 15,5. Un exemple de toxicité aiguë, le syndrome de Goodpasture par intoxication aux hydrocarbures, est causé par la présence dans le sérum d’anticorps dirigés contre le foie et les cellules pulmonaires, avec une réactivité croisée pour la membrane basale glomérulaire. Une exacerbation d’un syndrome néphrotique avec des quantités importantes de protéines dans les urines a également été observée chez des individus réexposés à des solvants organiques, tandis que d’autres études révèlent un lien temporel entre ces expositions et divers troubles rénaux. D’autres solvants, tels que les agents dégraissants, les peintures et les colles, jouent un rôle dans les formes plus chroniques de la maladie. Grâce aux connaissances acquises sur les mécanismes d’excrétion et de réabsorption des solvants, on peut identifier des marqueurs biologiques parce que même des lésions glomérulaires discrètes s’accompagnent de globules rouges en quantité anormale dans l’urine. Bien que la présence de globules rouges dans l’urine soit un signe cardinal de lésion glomérulaire, il est important d’éliminer les autres causes d’hématurie.
Néphrite tubulo-interstitielle. Comme mentionné précédemment, l’étiologie de l’insuffisance rénale chronique dépassée est souvent difficile à déterminer. Elle peut être de nature essentiellement glomérulaire, tubulaire ou interstitielle, apparaître soit à la suite de multiples épisodes aigus, soit sous l’effet d’expositions chroniques à de faibles doses de toxiques. La néphrite tubulo-interstitielle chronique se caractérise par une fibrose de l’interstitium et une atrophie tubulaire. Dans sa forme aiguë, on observe un important infiltrat inflammatoire associé à une collection liquidienne dans les espaces interstitiels. La néphrite tubulo-interstitielle peut concerner essentiellement l’interstitium ou bien se manifester à la suite de lésions tubulaires chroniques, ou encore être la conséquence de causes postrénales, telles qu’une obstruction. L’enzyme prostaglandine-A-synthétase tire son origine essentiellement dans l’interstitium et intervient dans le réticulum endoplasmique de la «chaîne de fabrication de protéines» de la cellule. Certains produits xénobiotiques, tels que la benzidine et les nitrofuranes, sont des cosubstrats réducteurs pour la prostaglandine-A-synthétase et exercent une toxicité envers l’interstitium.
Les néphrites tubulo-interstitielles peuvent être provoquées par une exposition au cadmium, au plomb, ainsi qu’à un certain nombre de solvants organiques. Dans la plupart des cas, il s’agit d’expositions chroniques à de faibles doses et la toxicité passe inaperçue à cause de la réserve de fonction rénale et de la capacité qu’a le rein de restaurer certaines de ses fonctions. Une néphrite tubulo-interstitielle peut également être la conséquence de lésions vasculaires, par exemple par intoxication chronique au monoxyde de carbone. Les cellules des tubes contournés proximaux sont les plus vulnérables aux substances toxiques présentes dans le sang en raison d’une exposition intense aux toxines qui traversent le glomérule, de la présence de systèmes enzymatiques internes qui activent les toxiques et du transport sélectif de ces derniers. Selon l’épithélium des différents segments du tube pro-ximal, les enzymes lysosomiales peroxydasiques et d’autres composantes des mécanismes génétiques ont des caractéristiques légèrement différentes. Ainsi, la toxicité au chrome peut se révéler par des lésions à la fois interstitielles et tubulaires. Des lésions des tubes collecteurs peuvent survenir lorsque des enzymes spécifi-ques activent des substances xénobiotiques telles que le chloroforme, l’acétaminophène et le p-aminophénol, de même que des antibiotiques comme la loradine. Une conséquence indirecte des lésions des tubes collecteurs est l’incapacité du rein d’acidifier l’urine, avec pour corollaire l’apparition d’une acidose métabolique.
Diabète insipide néphrogénique. Cette maladie héréditaire ou acquise se caractérise par une dilution anormale de l’urine. La forme héréditaire implique des mutations des récepteurs à l’hormone antidiurétique (ADH) qui sont localisés sur la membrane basale et baso-latérale des tubes collecteurs et dans la branche descendante de l’anse de Henle. L’ADH régule précisément la réabsorption d’eau et de certains ions tels que le potassium. Le diabète insipide acquis peut concerner les cellules tubulaires ou l’interstitium, ces deux éléments pouvant être atteints par diverses pathologies. Le diabète insipide néphrogénique peut s’observer dans l’insuffisance rénale dépassée à la suite d’une atteinte diffuse de l’interstitium. Ce dernier est alors incapable de maintenir l’environnement hypertonique nécessaire aux mouvements passifs d’eau à partir des tubes collecteurs. Les maladies qui entraînent des altérations interstitielles diffuses sont notamment les pyélonéphrites, l’anémie falciforme et les uropathies obstructives. Lorsqu’elles sont associées à des expositions professionnelles, ces maladies rendent le rein plus vulnérable aux substances xénobiotiques. On a pu établir qu’un petit nombre de composés néphrotoxiques nuisent particulièrement aux cellules des tubes collecteurs. Une pollakiurie diurne ou nocturne (mictions fréquentes) et une polydipsie (soif excessive) sont les principaux symptômes du diabète insipide néphrogénique. En réponse à l’ADH, les mouvements des liquides à travers les cellules des tubes collecteurs génèrent des canaux qui affectent la fonction microtubulaire des cel-lules. Ainsi, des médicaments tels que la colchicine sont susceptibles d’affecter l’ADH. Deux médicaments semblent agir par des mécanismes légèrement différents pour contrer l’ADH: l’hydrochlorothiazide et l’indométhacine, inhibiteur de la prostaglandine synthétase.
Le diabète insipide consécutif à un traitement au lithium dépend de la durée du traitement, du taux sérique moyen de lithium et de la dose totale de carbonate de lithium absorbée. Il est intéressant de constater que le lithium se concentre dans les tubes collecteurs et affecte l’adénosine monophosphorique cyclique (AMP) qui joue un rôle dans le mécanisme de transport actif des ions. Les expositions à d’autres composés, tels que le méthoxyflurane et la déméclocycline (utilisée dans le traitement de l’acné), peuvent également entraîner un diabète insipide néphrogénique par une voie différente qui rend les cellules épithéliales insensibles à l’ADH.
Hypertension. L’élévation de la pression artérielle, qui est la deuxième cause la plus fréquente d’insuffisance rénale dépassée, peut être attribuable à de très nombreux mécanismes étiologiques. L’hypertension artérielle peut être causée par une néphropathie diabétique, une néphropathie obstructive, une glomérulonéphrite, une maladie polykystique du rein, une pyélonéphrite ou une vasculite, beaucoup de ces maladies étant elles-mêmes liées à l’exposition à des composés toxiques. Un petit nombre d’expositions professionnelles sont directement corrélées à l’apparition de l’hypertension artérielle. L’une d’elles est la toxicité au plomb qui entraîne une ischémie glomérulaire et des lésions tubulo-interstitielles. Le mécanisme de l’hypertension artérielle induite par le plomb est probablement sous la dépendance de l’appareil juxtaglomérulaire, par le biais de la libération de rénine et la transformation de la rénine par les enzymes hépatiques en angiotensine II. Les médicaments pouvant entraîner de l’hypertension artérielle sont notamment les amphétamines, les œstrogènes et les contraceptifs oraux, les stéroïdes, le cisplatine, l’alcool et les antidépresseurs tricycliques. L’hypertension artérielle peut apparaître de façon progressive ou se déclarer brutalement dans les formes malignes. L’hypertension artérielle maligne, caractérisée par une pression artérielle diastolique supérieure à 110 mm Hg, s’accompagne de nausées, de vomissements et de céphalées sévères et constitue une urgence médicale. On dispose de nombreux médicaments pour la combattre, mais un traitement trop brutal peut entraîner une hypoperfusion rénale et, secondairement, une perte supplémentaire de fonction rénale. Chaque fois que possible, le traitement de choix consistera à soustraire la personne intoxiquée à la substance néphrotoxique.
L’hématurie (GR dans l’urine) et la pyurie (GB dans l’urine) sont les symptômes primaires de nombreuses maladies du système rénal et urinaire et peuvent être considérées, à des fins de classification, comme des marqueurs biologiques cellulaires non spécifiques. En raison de leur importance, elles feront l’objet de commentaires séparés. Le problème qui se pose aux médecins du travail consiste à déterminer si une hématurie est le signe d’une maladie chronique occulte susceptible de mettre en danger la vie du patient ou si elle est imputable à des expositions de nature professionnelle. L’évaluation clinique d’une hématurie doit s’appuyer sur une méthode normalisée permettant de déterminer si l’hématurie est d’origine prérénale, rénale ou postrénale.
Une hématurie peut faire suite à des lésions du rein proprement dit ou à des lésions à n’importe quel niveau des voies excrétrices urinaires, notamment le rein, le bassinet, les uretères, la vessie, la prostate et l’urètre. Un épisode unique d’hématurie impose un examen médical ou urologique en raison de la gravité de certaines maladies associées à ce symptôme. La présence de plus d’un globule rouge au fort grossissement microscopique peut être pathologique. Cependant, une hématurie importante peut passer inaperçue à l’examen microscopique lorsque l’urine est hypotonique (diluée) avec hémolyse subséquente. Une pseudo-hématurie peut être causée par les betteraves, les baies, les colorants végétaux et les fortes concentrations en urate. Une hématurie initiale suggère une origine urétrale; une hématurie terminale est généralement d’origine prostatique; et une hématurie permictionnelle est d’origine vésicale, rénale ou urétérale. Dans 21% des cas de tumeurs vésicales, on observe une hématurie majeure, tandis qu’une hématurie microscopique n’est constatée que dans 2,2 à 12,5% de ces maladies.
La découverte de cellules dysmorphiques lors de l’évaluation quantitative d’une hématurie suggère une origine haute, en particulier en présence de cylindres hématiques. La relation entre l’hématurie et la protéinurie permet d’en savoir plus. Le filtre glomérulaire arrête pratiquement toutes les protéines de poids moléculaire supérieur à 250 000 daltons, tout en laissant passer librement les protéines de faible poids moléculaire qui seront réabsorbées normalement par les cellules tubulaires proximales. La présence de protéines de poids moléculaire élevé dans l’urine indique un saignement au niveau inférieur du tractus, tandis que la présence de protéines de faible poids moléculaire est un signe de lésions tubulaires. L’examen du rapport alpha–1-microglobuline/albumine et a–2-macroglobuline/albumine permet de différencier les néphropathies glomérulaires des néphropathies tubulo-interstitielles et des saignements de la portion distale des voies excrétrices pouvant signer une néoplasie urothéliale et d’autres causes postrénales, comme les infections des voies excrétrices urinaires.
Un problème diagnostique particulier se pose lorsque deux ou plusieurs processus pathologiques responsables du même symptôme sont présents simultanément, par exemple, une hématurie dans une néoplasie urothéliale combinée à une infection des voies urinaires. Si un patient est atteint des deux types de maladies et que l’infection est traitée et éradiquée, le cancer demeure. Par conséquent, il est important de déterminer la vraie cause des symptômes. Dans la population, on trouve une hématurie chez 13% des individus soumis à un dépistage. Dans environ 20% des cas, il s’agit de pathologies rénales ou vésicales significatives et 10% d’entre elles vont donner lieu à des tumeurs malignes du tractus urinaire. Par conséquent, une hématurie constitue un marqueur biologique important de pathologie et mérite d’être prise en compte de façon appropriée.
L’interprétation clinique d’une hématurie est meilleure si on tient compte de l’âge et du sexe du patient. On peut le voir au tableau 8.2 qui montre les causes d’hématuries en fonction de ces deux critères. Les autres causes d’hématuries comprennent la thrombose de la veine rénale, une hypercalciurie ou une vasculite et les traumatismes, tels que la course ou d’autres sports, ainsi que les expositions et événements de nature professionnelle. L’évaluation clinique d’une hématurie nécessite une radiographie des reins, une urographie intraveineuse (UIV) pour éliminer les autres maladies des voies urinaires hautes, notamment les calculs et tumeurs rénales, et une cystoscopie (examen de la vessie au moyen d’un dispositif optique muni d’une source lumineuse) pour exclure la présence de cancer de la vessie, de la prostate ou de l’urothélium. Chez les femmes, il faut éliminer les origines génitales discrètes. En cas d’hématurie, et quel que soit l’âge du patient, une évaluation clinique s’impose et, en fonction de l’étiologie, des contrôles itératifs pourront être utiles.
|
0 à 20 ans |
40 à 60 ans (femmes) |
|
Glomérulonéphrite aiguë |
Infection aiguë des voies urinaires |
|
20 à 40 ans |
60 ans et plus (hommes) |
|
Infection aiguë des voies urinaires |
Hyperplasie prostatique bénigne |
|
40 à 60 ans (hommes) |
60 ans et plus (femmes) |
|
Tumeur vésicale |
Tumeur vésicale |
Source: Wyker, 1991.
L’utilisation conjointe de marqueurs biologiques récemment découverts et de la cytologie conventionnelle pour l’évaluation d’une hématurie permet de s’assurer qu’aucune pathologie maligne occulte ou débutante ne passe inaperçue (voir ci-après la partie sur les marqueurs biologiques). Pour le spécialiste de la médecine du travail, il est important de déterminer si l’hématurie est due à l’exposition à un produit toxique ou à un cancer occulte. Le type d’exposition et l’âge du patient sont des paramètres capitaux pour pouvoir prendre une décision clinique responsable. Une étude récente a démontré que les deux meilleurs indicateurs de lésions vésicales précancéreuses étaient l’hématurie et les marqueurs biologiques sur cellules urinaires desquamées en provenance de la vessie. Dans tous les cas de lésions glomérulaires, on observe une hématurie chez seulement 60% des patients atteints de cancer de la vessie et 15% des patients porteurs de pathologies malignes au niveau du rein lui-même. Par conséquent, l’hématurie reste un symptôme important de maladies rénales et postrénales sans pour autant être spécifique.
Traditionnellement, les dosages des substances toxiques sur le lieu de travail ont constitué la principale méthode d’identification des risques de toxicité auxquels sont exposés les travailleurs. Cependant, on ne connaît pas tous les produits toxiques et, par conséquent, certains échappent à la surveillance. De plus, du fait des variations individuelles de prédisposition, les substances xénobiotiques affecteront certains sujets et pas d’autres.
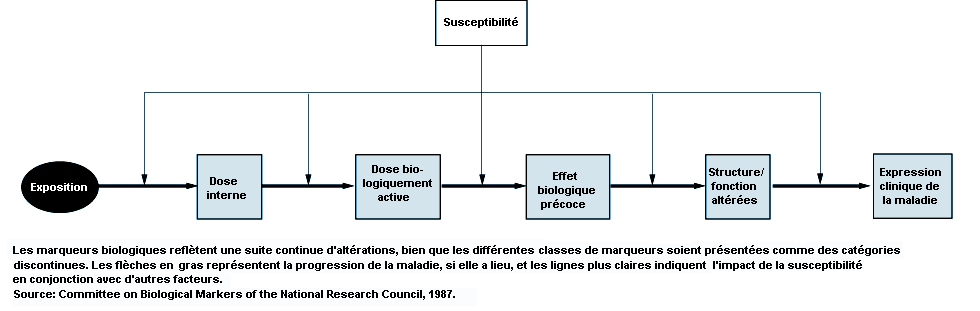
Les marqueurs biologiques offrent de nouvelles possibilités pour définir les risques individuels. A des fins descriptives, et pour faciliter les interprétations, on les classe selon le modèle de la Figure 8.2. Comme dans d’autres maladies, les marqueurs biologiques de toxicité rénale et génito-urinaire témoignent de la sensibilité, de l’exposition, de l’effet ou de la maladie. Les marqueurs biologiques sont soit génotypiques, soit phénotypiques et peuvent être de type fonctionnel, cellulaire ou soluble dans l’urine, le sang ou d’autres fluides corporels. On trouve des exemples de marqueurs solubles parmi les protéines, les enzymes, les cytokines et les facteurs de croissance. Le dosage des marqueurs biologiques peut se faire au niveau du gène, de l’ARN messager ou de la protéine. La multiplicité de ces systèmes ajoute à la complexité de l’évaluation et de la sélection du marqueur. Le dosage d’une protéine peut être particulièrement utile parce qu’il s’agit de la molécule fonctionnelle «en bout de chaîne de production». Le gène, lui, peut ne pas être transcrit et la quantité d’ARN messager peut ne pas correspondre à la quantité de protéines. Le tableau 8.3 donne une liste des critères utilisés pour la sélection des marqueurs biologiques.
|
Utilité clinique |
Considérations relatives aux dosages |
|
Puissance en tant que marqueur biologique |
Stabilité du réactif |
|
Sensibilité |
Coût du réactif |
|
Spécificité |
Conditions de fixation |
|
Valeur prédictive négative |
Reproductibilité du dosage |
|
Valeur prédictive positive |
Sensibilité à la technologie utilisée |
|
Rôle fonctionnel |
Contribution au profil du marqueur biologique |
|
Séquence dans l’oncogenèse |
Possibilité d’automatisation |
Source: Hemstreet et coll., 1996.
La détermination à dresser la carte du génome humain dont fait preuve la communauté scientifique internationale, projet rendu possible par les progrès de la biologie moléculaire, a jeté les bases des principes d’identification des marqueurs biologiques de susceptibilité. La plupart des maladies humaines, notamment celles qui sont dues à une exposition à des toxiques de l’environnement, mettent en jeu une myriade de gènes qui reflètent une forte diversité génétique (polymorphisme). Un exemple d’un tel phénomène, déjà mentionné plus haut, est le système enzymatique oxydatif P-450 capable de métaboliser les substances xénobiotiques au niveau du foie, du rein ou de la vessie. Les facteurs de prédisposition peuvent également contrôler le mécanisme essentiel qui sous-tend la réparation de l’ADN et influencer la sensibilité à plusieurs types de signaux importants pour l’oncogenèse (facteurs de croissance). Ces facteurs pourraient aussi expliquer des états pathologiques transmis de façon héréditaire et qui prédisposeraient à la maladie. L’expression phénotypique d’acétylation, lente ou rapide, qui détermine l’acétylation et l’inactivation de certaines amines aromatiques considérées comme étant responsables de cancers de la vessie, constitue un exemple important de facteur de prédisposition héréditaire. Les marqueurs biologiques de susceptibilité comprennent, outre les gènes qui régulent l’activation des substances xénobiotiques, des proto-oncogènes et des oncogènes suppresseurs. Le contrôle de la croissance de la cellule tumorale met en jeu un certain nombre de systèmes complexes interactifs. Ces derniers comprennent un équilibre de (proto)oncogènes positifs et d’oncogènes (suppresseurs) négatifs. Les proto-oncogènes contrôlent la croissance normale de la cellule et son développement, tandis que les oncogènes suppresseurs commandent la division cellulaire normale et la différenciation cellulaire. D’autres gènes peuvent contribuer à des états pathologiques préexistants, comme une tendance à l’insuffisance rénale consécutive à des maladies sous-jacentes telles que les polykystoses.
La substance xénobiotique elle-même peut constituer le marqueur biologique d’exposition, de même qu’un produit du métabolisme ou des adduits de l’ADN. Dans certains cas, le marqueur biologique est lié à une protéine. Les marqueurs biologiques d’exposition peuvent être en rapport avec l’effet provoqué si ce dernier est transitoire. Si un marqueur biologique d’effet persiste, il peut devenir un marqueur biologique de maladie. Pour être utile, les marqueurs biologiques d’effet doivent être étroitement corrélés à un toxique et donc indiquer une exposition. Pour le dépistage de maladies, l’expression d’un marqueur biologique peu de temps après le début de la maladie fournit la meilleure spécificité. La sensibilité et la spécificité d’un marqueur biologique dépend du rapport entre les risques et les bénéfices que l’on peut attendre du dépistage. Par exemple, un marqueur biologique tel que la F-actine, témoin de différenciation des protéines du cytosquelette, qui présente un aspect modifié au stade précoce de l’oncogenèse, peut n’avoir qu’une faible spécificité pour la détection des états précancéreux parce que tous les individus chez qui on trouve ce marqueur anormal ne développeront pas la maladie. Il peut cependant être utile pour sélectionner les individus et les mettre sous surveillance pendant une chimioprévention, pour autant que le traitement ne soit pas toxique. Il est extrêmement utile de comprendre l’évolution temporelle et le lien fonctionnel entre les différents marqueurs biologiques pour évaluer le risque individuel et comprendre les mécanismes de l’oncogenèse et de la néphrotoxicité.
Les marqueurs biologiques de néphrotoxicité peuvent être en rapport avec l’étiologie de l’insuffisance rénale (pré-rénale, rénale ou post-rénale) et avec les mécanismes impliqués dans la pathogenèse du processus morbide, c’est-à-dire les lésions cellulaires et leur réparation. Les lésions induites par des produits toxiques peuvent se produire au niveau des cellules, du glomérule, de l’interstitium ou des tubules, avec une libération de marqueurs correspondant au niveau lésé. Les substances xénobiotiques peuvent affecter plus d’un compartiment ou être détectées par des marqueurs biologiques en raison de l’interdépendance des cellules à l’intérieur du compartiment. Les perturbations inflammatoires, les maladies auto-immunes et les processus immunologiques renforcent la libération de marqueurs biologiques. Comme c’est le cas pour le mercure, les substances xénobiotiques peuvent s’attaquer à différents compartiments suivant les circonstances. Une exposition aiguë à ce métal se manifeste par une toxicité au niveau des tubes proximaux des reins, tandis que les effets chroniques concernent surtout les artérioles. La réaction à l’agression peut être subdivisée en plusieurs grandes catégories, notamment l’hypertrophie, la prolifération, la dégénérescence (nécrose et apoptose ou mort cellulaire programmée) et les altérations membranaires.
La majorité des facteurs de susceptibilité sont associés à des maladies rénales non provoquées par des produits xénobiotiques. Cependant, 10% des cas d’insuffisance rénale sont attribués à des expositions à des composés toxiques présents dans le milieu ambiant ou à une induction iatrogène par divers composés, comme certains antibiotiques, ou encore à des procédures iatrogènes telles que l’injection d’un produit de contraste néphrographique chez une personne diabétique. Sur le lieu de travail, l’identification d’une insuffisance rénale subclinique avant toute exposition à un stress néphrotoxique additionnel présente une utilité pratique. Si on soupçonne un composé d’être néphrotoxique et que l’effet de ce composé est d’agir dans le sens du développement de la maladie, il est alors possible d’intervenir pour en renverser les effets. Par conséquent, les marqueurs biologiques d’effet éliminent nombre des problèmes soulevés par les calculs de l’exposition et par la définition de la prédisposition individuelle. L’analyse statistique des marqueurs biologiques d’effet en relation avec les marqueurs biologiques de susceptibilité et d’exposition devrait améliorer leur spécificité en tant que tels. Plus le marqueur biologique d’effet est spécifique, moins il est nécessaire de disposer d’un grand échantillon pour identifier de façon scientifique les agents toxiques potentiels.
Les marqueurs biologiques d’effet sont les plus importants des marqueurs et révèlent le lien entre l’exposition, d’une part, et la sensibilité et la maladie, de l’autre. Nous avons traité plus haut de l’emploi conjugué de marqueurs biologiques cellulaires et solubles pour distinguer une hématurie des voies urinaires hautes d’une hématurie des voies urinaires basses. Le tableau 8.4 donne la liste des marqueurs biologiques solubles pouvant être liés à une néphrotoxicité cellulaire. A ce jour, aucun de ces marqueurs, seuls ou en association, ne permet de déceler une toxicité subclinique avec une sensibilité satisfaisante. L’utilisation de marqueurs biologiques solubles pose certains problèmes en rapport avec leur manque de spécificité, l’instabilité enzymatique, l’effet de dilution de l’urine, des variations de la fonction rénale et des interactions protéiques non spécifiques qui peuvent atténuer la spécificité du test.
|
Facteurs immunologiques: |
Composants de la matrice extracellulaire: |
|
Lymphokines |
Molécules d’adhérence |
|
Antigènes majeurs d’histocompatibilité |
Radicaux oxygénés et azotés réactifs |
|
Facteurs de croissance et cytokines: |
Facteurs de transcription et proto-oncogènes: |
|
Médiateurs lipidiques: prostaglandines |
Thromboxanes; leucotriènes; et facteur d’activation plaquettaire |
|
Endothéline |
Protéines du stress (HSP) |
Source: Finn, Hemstreet et coll., dans National Research Council, 1995.
Un facteur de croissance soluble, aux applications cliniques prometteuses, est le facteur de croissance épidermique urinaire (EGF) qui peut être excrété par le rein et qui est altéré chez les patients atteints d’un carcinome à cellules transitionnelles de la vessie. On a essayé le dosage quantitatif des enzymes urinaires, mais l’utilité de ce procédé est restreinte parce qu’il ne permet pas d’établir l’origine de l’enzyme et n’est pas reproductible. La généralisation de l’utilisation d’enzymes urinaires s’est faite lentement à cause des critères restrictifs mentionnés ci-dessus. Les enzymes évaluées comprennent l’alanine aminopeptidase (alaminopeptidase), la NAG et la phosphatase alcaline intestinale. La NAG est peut-être le marqueur le plus largement accepté pour la surveillance des lésions des cellules des tubules proximaux en raison de sa localisation dans le segment S3 du tubule. Comme on ne connaît pas précisément l’origine cellulaire, ni la pathologie responsable de l’activité de cette enzyme dans l’urine, les résultats sont difficiles à interpréter. De plus, des médicaments, des techniques diagnostiques et des maladies concomitantes, telles qu’un infarctus du myocarde, peuvent compliquer l’interprétation.
Une autre approche consiste à utiliser des anticorps monoclonaux comme marqueurs biologiques pour identifier et quantifier les cellules tubulaires dans l’urine provenant de différents segments du néphron. Cette méthode n’est efficace que si l’on maintient l’intégrité de la cellule lors de la quantification, ce qui nécessite l’emploi d’une technique adéquate de fixation et de manipulation des échantillons. On dispose maintenant d’anticorps monoclonaux qui sont dirigés spécifiquement contre les cellules tubulaires et permettent de distinguer les cellules tubulaires proximales des cellules tubulaires distales ou des cellules des tubes contournés. Le microscope optique ne permet pas de différencier efficacement les leucocytes des divers types de cellules tubulaires, contrairement à la microscopie électronique, qui a prouvé son utilité pour détecter les rejets de greffes. Des techniques telles que l’analyse quantitative de cellules tubulaires imprégnées d’anticorps monoclonaux par microscopie à fluorescence devraient apporter la solution à ce problème. Dans un avenir proche, il devrait être possible de déceler une néphrotoxicité subclinique avec un haut degré de certitude en cas d’exposition.
Les carcinomes solides naissent souvent de groupes de cellules biochimiquement altérées qui peuvent ou non avoir subi des modifications histologiques ou cytologiques. Des techniques telles que l’analyse quantitative par microscopie à fluorescence pour détecter les marqueurs biologiques qui signent de façon certaine les états précancéreux ouvrent la perspective d’une chimioprévention ciblée. Les altérations biochimiques peuvent survenir de façon désordonnée ou séquentielle. Du point de vue phénotypique, ces changements s’expriment par une progression morphologique qui va de l’atypie à la dysplasie cellulaire et, finalement, à la néoplasie franche. Si on connaît le rôle fonctionnel d’un marqueur biologique et à quel moment dans la séquence de l’oncogenèse il s’exprime, on peut mieux définir la façon de l’utiliser pour identifier la maladie précancéreuse, poser un diagnostic précoce et mettre au point une combinaison de marqueurs biologiques permettant de prédire une récurrence ou une progression tumorale. Un paradigme nécessitant que soient identifiés des profils de marqueurs biologiques uniques et multiples se met actuellement en place pour l’évaluation des marqueurs biologiques.
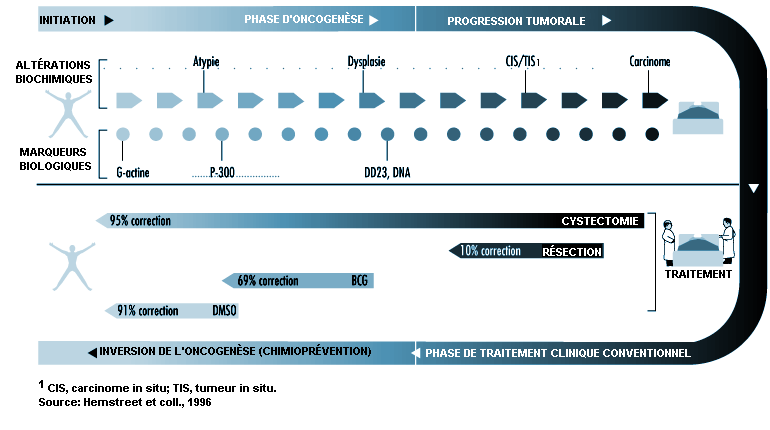
Le cancer de la vessie semble pouvoir évoluer selon deux modes distincts: un mode à minima qui serait associé à des altérations sur le chromosome 9 et un autre mode associé, lui, à une altération du gène suppresseur P-53 sur le chromosome 17. Il est clair que plusieurs facteurs génétiques influencent le développement de ce cancer et il est difficile de définir les déterminants génétiques en cause chez chaque individu, en particulier lorsque le mode de déclenchement génétique doit être comparé aux influences complexes d’expositions qui peuvent être multiples. Lors des études épidémiologiques, les expositions sur de longues périodes se sont révélées difficiles à reconstituer. Des combinaisons de marqueurs phénotypiques et génotypiques sont en cours d’identification et devraient permettre de définir quels individus sont à risque dans les groupes de sujets exposés professionnellement. La Figure 8.3 présente plusieurs marqueurs biologiques phénotypiques et leurs liens avec le cancer de la vessie. Ce diagramme montre que la G-actine, précurseur protéique de la F-actine (protéine du cyto-squelette), est un marqueur de différenciation précoce dont la présence peut être suivie par des altérations séquentielles d’autres marqueurs de seuil, par exemple M344, DD23 et la ploïdie de l’ADN. Il reste à déterminer quelles sont les combinaisons de marqueurs biologiques les plus efficaces pour mettre en évidence les états précancéreux et les cancers patents, de même que pour établir un pronostic. Lorsque les critères biochimiques pourront être établis au moyen de méthodes analytiques sensibles, il sera sans doute possible de déterminer un risque d’apparition de cancer à des étapes précises de l’oncogenèse.
Les changements survenus dans les systèmes de soins de santé partout dans le monde posent le problème de l’assurance des travailleurs et de leur protection en cas d’exposition excessive. Une maladie rénale préexistante importante se voit aux signes suivants: créatinine sérique augmentée; glycosurie (sucre dans l’urine); protéinurie; hématurie et dilution anormale de l’urine. Il importe d’éliminer immédiatement des pathologies systémiques, telles que le diabète et l’hypertension artérielle et, en fonction de l’âge du patient, des maladies congénitales comme les polykystoses rénales. De ce fait, l’examen des urines, tant par bandelettes que par analyse microscopique, est utile au médecin du travail pour déceler des altérations biochimiques et cellulaires. Des mesures de créatinine sérique et de clairance de la créatinine s’imposent en cas d’hématurie, de pyurie ou de protéinurie appréciables qui laissent soupçonner une pathologie sous-jacente.
Divers facteurs sont importants pour évaluer le risque de progression d’une maladie chronique ou d’apparition d’une insuffisance rénale aiguë. Le premier de ces facteurs, inhérent ou acquis, est la limite jusqu’à laquelle le rein est capable de résister à l’exposition à une substance xénobiotique toxique. La réaction du rein à l’agent néphrotoxique, par exemple l’augmentation de la quantité de toxique absorbée ou des altérations du métabolisme rénal, peut varier en fonction d’une pathologie préexistante. Une importance particulière doit être accordée à une diminution du pouvoir de détoxication chez les sujets très jeunes ou très âgés. Une étude a trouvé une forte corrélation entre la sensibilité à une exposition professionnelle et des antécédents familiaux de maladie rénale, ce qui étaie la thèse d’une prédisposition héréditaire. Les maladies sous-jacentes, comme le diabète et l’hypertension artérielle, augmentent la vulnérabilité rénale. Des maladies rares telles que le lupus érythémateux et les vasculites peuvent fragiliser le rein en présence de substances toxiques. Dans la majorité des cas, une sensibilité augmentée sera d’origine multifactorielle et sera souvent le résultat d’un ensemble d’agressions agissant de façon indépendante ou conjointe. Par conséquent, le médecin du travail doit être informé de tout antécédent familial de maladies rénales et de pathologies préexistantes pouvant nuire à la fonction rénale, de même que de toute maladie vasculaire ou cardiaque, en particulier chez les travailleurs âgés.
L’insuffisance rénale aiguë peut être d’origine prérénale, rénale ou postrénale. Cet état pathologique fait généralement suite à une agression massive et se caractérise par une perte de fonction rénale rapidement progressive. Lorsqu’on élimine le produit néphrotoxique ou le facteur causal déclenchant, on observe une récupération graduelle de la fonction rénale, parallèlement à une diminution de la créatininémie et une restauration du pouvoir de concentration du rein. Le tableau 8.5 donne une liste des causes professionnelles d’insuffisance rénale aiguë. L’observation de cas de ce type provoqués par l’exposition à des doses élevées de substances xénobiotiques a permis d’identifier des facteurs toxiques susceptibles également de contribuer à des formes plus chroniques de maladies rénales progressives. Il est assez rare d’observer une insuffisance rénale aiguë faisant suite à une obstruction des voies excrétrices par une maladie bénigne ou maligne, tandis que les origines chirurgicales sont plus fréquentes. Une échographie des voies urinaires supérieures permet de visualiser précisément l’élément obstructif, quel qu’il soit. L’insuffisance rénale provoquée par des médicaments ou des produits toxiques professionnels comporte un taux de mortalité d’environ 37% et les survivants récupèrent de façon variable.
|
Ischémie rénale |
Nécrose tubulaire |
Hémoglobinurie, myoglobinurie |
|
Choc traumatique |
Mercure |
Arsine |
Source: Crepet, 1983.
L’insuffisance rénale aiguë peut être due à un certain nombre de causes prérénales qui ont pour point commun une ischémie du rein par diminution prolongée de la perfusion rénale. L’insuffisance cardiaque et l’obstruction de l’artère rénale en sont deux exemples. Une nécrose tubulaire peut être causée par des néphrotoxiques dont la liste ne fait que s’accroître sur les lieux de travail. Les herbicides et les pesticides ont fait l’objet de nombreuses études. Un rapport décrit des dépôts de myosine et d’actine provenant de la lyse des cellules musculaires dans les tubules rénaux, avec une insuffisance rénale aiguë, à la suite d’une intoxication par la ciguë. L’endosulfane, un insecticide, et l’acétate de triphénylétain (ATPE), composé organo-stanneux, tous deux initialement classés comme neurotoxiques, ont récemment été mis en cause dans des cas de nécrose tubulaire. Des observations occasionnelles d’autres cas confirment qu’il est nécessaire de rechercher des marqueurs biologiques qui permettront d’identifier des substances toxiques subcliniques pour lesquelles aucun cas d’exposition toxique à haute dose n’a encore été relevé.
Les signes et symptômes de l’insuffisance rénale aiguë sont l’absence de débit urinaire (anurie), la diminution du débit urinaire (oligurie), la diminution du pouvoir de concentration du rein et/ou une augmentation du potassium sérique susceptible de provoquer un arrêt cardiaque lors de la phase de relaxation du myocarde (arrêt diastolique). Le traitement comprend des mesures palliatives cliniques et, chaque fois que possible, la cessation de l’exposition. L’augmentation du potassium sérique, ou une rétention liquidienne excessive constituent les deux paramètres essentiels menant à la décision de pratiquer soit une hémodialyse, soit une dialyse péritonéale, le choix entre ces deux techniques dépendant de la stabilité cardio-vasculaire du patient, ainsi que d’un accès veineux pour l’hémodialyse. Le néphrologue est au centre de la stratégie de prise en charge de ces patients et peut également être secondé par un urologue.
Le traitement de long cours des patients souffrant d’une insuffisance rénale aiguë dépend beaucoup de leur récupération et de leur réadaptation, ainsi que de leur état de santé général. On recommande une reprise partielle du travail en évitant évidemment tout facteur susceptible d’aggraver la pathologie sous-jacente. Les patients chez qui persiste une hématurie ou une pyurie ont besoin d’une surveillance étroite, éventuellement par marqueurs biologiques, pendant les deux années qui suivent la phase aiguë.
L’insuffisance rénale chronique ou dépassée est le plus souvent la conséquence d’un processus pathologique chronique et subclinique de longue durée qui peut être dû à toute une série de facteurs dont la plupart restent mal compris. Les glomérulonéphrites, les maladies cardio-vasculaires, dont l’hypertension artérielle, sont des facteurs contributifs importants. Le diabète et les substances néphrotoxiques participent également à la dégradation de la fonction rénale. L’insuffisant rénal chronique présente une élévation progressive des taux sériques de l’azotémie, de la créatininémie et du potassium sérique, ainsi qu’une oligurie. De meilleurs marqueurs biologiques, ou des combinaisons de marqueurs biologiques, sont nécessaires pour identifier plus précisément les néphrotoxicités subcliniques. Pour le médecin du travail, les méthodes d’évaluation doivent être non invasives, hautement spécifiques et reproductibles. Aucun marqueur biologique unique ne réunit, à ce jour, ces critères qui permettraient une utilisation clinique à grande échelle.
Nombre de produits néphrotoxiques peuvent entraîner une insuffisance rénale chronique par des mécanismes pathogéniques pas toujours connus. Le tableau 8.6 donne une liste des produits néphrotoxiques et des sites où s’exerce la toxicité. Comme nous l’avons déjà mentionné, les substances toxiques peuvent s’attaquer aux glomérules, aux différents segments des tubules ou bien aux cellules de l’interstitium. L’exposition à un produit xénobiotique toxique pour le rein peut être suivie des symptômes suivants: hématurie; pyurie; glycosurie; présence d’acides aminés dans l’urine; mictions fréquentes; oligurie. Pour de nombreux néphrotoxiques, les mécanismes précis des lésions rénales ne sont pas encore complètement élucidés. Cependant, l’identification de marqueurs spécifiques de néphrotoxicité devrait permettre un progrès des connaissances dans ce domaine. Même s’il est possible, dans une certaine mesure, de protéger le rein par une prévention de la vasoconstriction, les lésions tubulaires persistent dans la plupart des cas. Par exemple, la toxicité du plomb est surtout due à des effets vasculaires, tandis que celle du chrome à faibles doses se manifeste au niveau des cellules des tubules proximaux. Ces métaux semblent affecter les mécanismes métaboliques vitaux de la cellule. De multiples formes de mercure ont été incriminées dans des cas de néphrotoxicité aiguë due aux métaux lourds. Le cadmium, contrairement au mercure, et de façon comparable à de nombreux autres produits néphrotoxiques employés en milieu professionnel, s’attaque essentiellement aux cellules des tubes proximaux.
|
Tube proximal |
Glomérule |
Source: Tarloff et Goldstein, 1994.
Traditionnellement, on emploie le terme «cancer du rein» pour désigner soit l’ensemble des tumeurs malignes du système rénal et urinaire (rein, CIM-9 189.0; bassinet, CIM-9 189.1; uretère, CIM-9 189.2), soit les tumeurs malignes du rein (néphrocarcinome) uniquement. Ce type de classification a entraîné une certaine confusion dans les études épidémiologiques et nécessité une nouvelle analyse des données rassemblées. Les néphrocarcinomes représentent 75 à 80% de l’ensemble, le reste étant constitué essentiellement de carcinomes à cellules transitionnelles du bassinet du rein et de l’uretère. Il est logique de distinguer ces deux types de cancers, puisque la pathogenèse du néphrocarcinome diffère sensiblement de celle du carcinome à cellules transitionnelles et que les facteurs de risques épidémiologiques, de même que les signes et symptômes de ces deux maladies sont différents. Le présent article porte essentiellement sur le néphrocarcinome.
Le principal facteur de risque identifié pour le cancer du rein est le tabagisme, suivi par des facteurs de risque présumés, mais mal définis, d’ordre professionnel ou liés à l’environnement. On estime que l’élimination du tabagisme entraînerait une diminution de 30 à 40% du nombre des cancers du rein dans les pays industriels, mais les facteurs étiologiques professionnels du néphrocarcinome ne sont pas bien établis. Le risque imputable à des expositions professionnelles se situe entre zéro, si on se base sur une oncogenèse confirmée, et 21% selon une étude cas-témoins multicentrique sur sites multiples, menée au Canada, dans la région de Montréal. L’utilisation conjointe de marqueurs biologiques d’effet précoce et de marqueurs biologiques d’exposition devrait permettre d’établir plus aisément les facteurs de risque importants. Des études épidémiologiques ont mis en évidence une plus grande fréquence de cancer rénal dans plusieurs catégories professionnelles et branches d’activités. Cependant, les données disponibles actuellement ne sont pas concordantes sauf dans le cas des produits utilisés pour le nettoyage à sec et les expositions professionnelles dans le raffinage du pétrole. Une analyse statistique des données épidémiologiques d’exposition, en fonction des marqueurs biologiques de susceptibilité et d’effet, permettra d’identifier avec certitude un plus grand nombre de facteurs étiologiques.
Plusieurs études épidémiologiques ont établi un lien entre un certain nombre de branches d’activité, de professions et d’expositions professionnelles spécifiques et un risque accru de carcinome du rein. La tendance qui se dégage de ces études n’est pas entièrement cohérente. Le raffinage du pétrole, l’imprimerie, le nettoyage à sec et la conduite de camions sont des exemples d’emplois où le risque de développer un cancer du rein est anormalement élevé. Les agriculteurs sont généralement moins touchés par le néphrocarcinome que la moyenne, mais une étude danoise a établi un lien entre des expositions chroniques à long terme aux insecticides et herbicides et une fréquence de néphrocarcinomes presque quatre fois supérieure à la normale. Cette constatation doit être confirmée par des observations indépendantes qui devront inclure une spécification de la nature causale possible de l’association. D’autres produits, que l’on soupçonne d’être responsables de néphrocarcinomes, sont les dérivés d’hydrocarbures et les solvants, les produits du raffinage du pétrole, les produits pétroliers, le goudron et le brai, les émanations d’essence, les carburéacteurs, les émissions des moteurs d’avions à réaction et des moteurs diesel, les composés arsenicaux, le cadmium, les composés chromiques (Cr VI), les composés minéraux du plomb et l’amiante. Des études épidémiologiques ont mis en évidence une relation entre l’exposition aux vapeurs d’essence et le cancer du rein, dans certains cas selon un mode dose-dépendant. Ce phénomène a été observé chez le rat mâle lors d’expositions à des vapeurs d’essence sans plomb. Ces observations sont à prendre au sérieux étant donné la fréquence des expositions humaines à ce type d’émanations dans les stations-service et la récente augmentation de cas de cancers du rein. L’essence est composée d’un mélange d’hydrocarbures et d’additifs, dont le benzène, produit au pouvoir cancérogène reconnu chez l’humain.
Le risque de cancer du rein n’est pas systématiquement lié à la classe sociale, bien que, occasionnellement, l’on ait pu observer une plus grande fréquence de cette maladie dans les classes socio-économiques élevées. Cependant, dans certaines populations, la tendance inverse a été relevée, tandis que dans d’autres, aucune tendance ne se dégage. Il est possible que ces variations soient liées à des modes de vie différents. Des études menées chez des travailleurs migrants montrent que le risque de développer un néphrocarcinome se modifie chez eux pour atteindre progressivement le même niveau que celui de la population du pays hôte, ce qui laisse à penser que les facteurs de l’environnement jouent un rôle important dans le développement de ces cancers.
A l’exception du néphroblastome (tumeur de Wilms), qui est un cancer de l’enfance, le cancer du rein survient généralement après l’âge de 40 ans. En 1985, on a dénombré environ 127 000 nouveaux cas de cancers du rein (néphrocarcinomes et carcinomes à cellules transitionnelles du bassinet et de l’uretère), ce qui correspond à 1,7% du nombre total de cancers observés dans le monde. La fréquence des cancers du rein varie selon les populations. Des taux élevés ont été rapportés chez les hommes et chez les femmes en Amérique du Nord, en Australie, en Europe et en Nouvelle-Zélande. Par contre, on a observé des taux relativement bas en Afrique centrale et de l’Est, en Mélanésie, ainsi qu’en Asie de l’Est et du Sud-Est. L’incidence des cancers du rein a aug-menté dans la plupart des pays occidentaux, mais s’est stabilisée dans un petit nombre d’entre eux. En 1985, le taux comparatif d’incidence du cancer du rein, ramené à l’âge, était le plus élevé en Amérique du Nord et en Europe septentrionale, occidentale et orientale, et le plus faible en Afrique, en Asie (sauf chez les hommes japonais) et dans le Pacifique. Le cancer du rein touche préférentiellement les hommes et se situe parmi les dix cancers les plus fréquents dans un bon nombre de pays.
Le carcinome à cellules transitionnelles du bassinet du rein est corrélé à des agents étiologiques similaires à ceux qui provoquent le cancer de la vessie, notamment les infections chroniques, les lithiases et les analgésiques contenant de la phénacétine. La néphropathie des Balkans, néphropathie progressive lente, chronique et fatale qui est fréquente dans les pays balkaniques, va de pair avec des taux élevés de tumeurs du bassinet du rein et de l’uretère. Les causes en sont inconnues. Une exposition excessive à l’ochratoxine A, considérée comme potentiellement cancérogène chez l’humain, a été soupçonnée dans la pathogenèse de ce type de néphropathie, mais on ne peut pas exclure que d’autres produits néphrotoxiques jouent aussi un rôle. L’ochratoxine A est une toxine produite par des champignons que l’on retrouve dans de nombreux produits alimentaires, en particulier les céréales et les produits contenant de la viande de porc.
Les signes et symptômes évocateurs du néphrocarcinome diffèrent selon les patients, même lorsque la maladie atteint le stade métastatique. Etant donné la localisation des reins et la mobilité des organes adjacents par rapport au développement de la masse tumorale, ces tumeurs peuvent souvent atteindre une dimension considérable avant d’être cliniquement décelables. Même si l’hématurie est le symptôme principal du néphrocarcinome, du fait de la localisation intrarénale du néphrocarcinome, les saignements surviennent tard par rapport aux tumeurs à cellules transitionnelles. Ce type de cancer a été considéré comme le «rêve du docteur», mais le «cauchemar du chirurgien», en raison de la myriade de symptômes associés aux syndromes paranéoplasiques. On a rapporté la présence de substances qui stimulent la production de globules rouges, ainsi que la présence de calcium et de facteurs qui miment la fonction de la glande surrénale. On observe une masse abdominale, une perte de poids, une fatigue, des douleurs, une anémie, une fonction hépatique perturbée et de l’hypertension artérielle. Grâce à l’utilisation de plus en plus fréquente de la tomodensitométrie de l’abdomen et de l’échographie, on estime que 20% environ des néphrocarcinomes sont diagnostiqués de façon fortuite dans le cadre d’investigations pour d’autres problèmes médicaux.
L’évaluation clinique d’un néphrocarcinome comporte un examen physique qui mettra en évidence une masse au niveau du flanc chez 10% des patients. Une radiographie avec un produit de contraste peut mettre en évidence le contour d’une masse rénale anormale dont la nature, solide ou kystique, sera généralement révélée par échographie ou tomodensitométrie. Ces tumeurs sont très vascularisées et présentent un aspect caractéristique lorsqu’on injecte un produit de contraste radio-opaque dans l’artère rénale. L’artériographie sert à emboliser la tumeur, si elle est de grande dimension, ou à en identifier les pédicules nourriciers artériels en vue d’une néphrectomie partielle. Une ponction cytologique à l’aiguille fine peut être effectuée pour prélever un échantillon présumé cancéreux.
On procède à l’exérèse chirurgicale des néphrocarcinomes, ainsi que des ganglions régionaux, en prenant soin en cours d’intervention de ligaturer précocement l’artère et la veine rénales. Les symptômes du patient pourront être soulagés par l’ablation de tumeurs volumineuses ou hémorragiques ayant métastasé, mais cette mesure n’améliore pas le pronostic vital. En ce qui concerne les métastases, un traitement symptomatique de la douleur peut être obtenu par radiothérapie, mais le traitement de choix de l’essaimage métastatique réside dans les modulateurs de réponse biologique (Interleukine 2 ou alpha-interféron), bien que l’on recoure parfois à la chimiothérapie, seule ou en association avec d’autres traitements.
Des marqueurs tels que le gène du cancer sur le chromosome 3, observé dans certaines familles à cancers et dans la maladie de von Hippel-Lindau (angiomatose de la rétine), peuvent servir de marqueurs biologiques de susceptibilité. Bien que l’on ait fait mention de marqueurs antigéniques tumoraux propres aux néphrocarcinomes, on ne dispose actuellement d’aucun moyen pour déceler ces derniers de façon fiable dans l’urine ou dans le sang avec une sensibilité et une spécificité suffisantes. Etant donné la faible prévalence de cette maladie dans la population générale, seul un test hautement spécifique et sensible permettrait son dépistage à un stade précoce. En principe, on pourrait pratiquer des dépistages par échographie sur des cohortes de sujets à risque travaillant dans des conditions comparables. Ce type de cancer demeure difficile à évaluer, que ce soit pour les scientifiques, les épidémiologistes moléculaires ou les cliniciens.
Plus de 90% des cancers de la vessie en Amérique du Nord et en Europe sont des carcinomes à cellules transitionnelles (CCT). Les carcinomes spinocellulaires et les adénocarcinomes représentent, respectivement, 5 et 1% des cancers de la vessie dans ces régions. La répartition des types histopathologiques de cancers de la vessie est radicalement différente dans des régions telles que l’Afrique et le Moyen-Orient, où ces cancers sont associés à la bilharziose. En Egypte, par exemple, où cette maladie est endémique et où le cancer de la vessie est la pathologie maligne la plus courante, le type de cancer le plus fréquent est le carcinome spinocellulaire, bien que l’incidence du carcinome à cellules transitionnelles ait tendance à augmenter avec le développement du tabagisme. Le présent article est consacré au carcinome à cellules transitionnelles.
Le cancer de la vessie continue d’être une maladie d’une importance considérable. En 1980, il représentait environ 3,5% de tous les néoplasmes à l’échelle mondiale. En 1985, le cancer de la vessie occupait la onzième place par ordre de fréquence dans le monde, ce qui le place en huitième position pour les cancers chez les hommes, avec au total 243 000 nouveaux cas attendus. On constate un pic de l’incidence entre 60 et 70 ans et, mondialement, il affecte trois hommes pour une femme. L’incidence de ce cancer a tendance à augmenter dans presque toutes les populations d’Europe, chez les hommes en particulier. Au Danemark, où les taux d’incidence annuels sont parmi les plus élevés au monde, avec 45 cas/100 000 hommes et 12 cas/100 000 femmes, la tendance récemment observée marque une augmentation du nombre de cas de 8 à 9% tous les cinq ans. En Asie, les taux très élevés chez les Chinois de Hong-kong ont baissé régulièrement, bien que pour les deux sexes l’incidence de cancers de la vessie demeure bien supérieure à celle constatée dans les autres pays d’Asie et deux fois plus élevée que chez les Chinois de Shanghai ou de Singapour. Les Chinois de Hawaï sont, eux aussi, fréquemment atteints.
La consommation de cigarettes est le facteur étiologique le plus important pour le cancer de la vessie, suivi directement par les facteurs d’exposition professionnelle. On a estimé que le tabac est responsable d’un tiers de tous les cas de cancers de la vessie dans les pays exempts de bilharziose. Le nombre de ces cancers attribués en 1985 au tabagisme a été estimé à plus de 75 000 dans le monde, et 50% de tous les cancers de la vessie des populations occidentales pourraient lui être imputables. Le fait que tous les individus ayant une consommation tabagique comparable ne courent pas le même risque de développer un cancer de la vessie laisse à penser que des facteurs génétiques interviennent également. Deux amines aromatiques, le 4-aminobiphényle et la 2-naphthylamine, sont des produits cancérogènes présents dans la fumée de cigarette. On les trouve en concentration plus élevée dans le tabac noir (séché naturellement) que dans le tabac blond (séché à l’air chaud). Le tabagisme passif qui augmente la formation d’adduits dans le sang a été corrélé, selon une relation dose-réponse, avec une plus grande fréquence de cancers de la vessie. Selon certaines observations, les fumeurs de cigarettes de type acétylateurs lents ont plus d’adduits que ceux de type acétylateurs rapides, ce qui suggère que le mode d’acétylation de l’individu, transmis de façon héréditaire, pourrait être un important marqueur biologique de susceptibilité. La plus faible incidence de cancers de la vessie chez les Noirs que chez les Blancs pourrait être due à la conjugaison d’intermédiaires métaboliques cancérogènes par des sulfotransférases productrices d’électrophiles. Les sulfates phénoliques détoxiqués pourraient avoir un effet protecteur de l’urothélium. Des études ont montré que l’activité de la sulfotransférase hépatique sur les N-hydroxyarylamines était plus importante chez les Noirs que chez les Blancs avec pour résultat une baisse du nombre de métabolites N-hydroxylés libres et de leurs effets cancérogènes.
Le cancer de la vessie d’origine professionnelle est l’un des cancers les plus connus et les mieux documentés dans le monde du travail. Le premier cas identifié de cancer de la vessie d’origine professionnelle est apparu vingt ans après le début de l’emploi des colorants artificiels en Allemagne. De nombreuses autres professions ont été reconnues au cours des vingt-cinq dernières années comme présentant un risque de cancer de la vessie. Selon les évaluations, jusqu’à 20% de ces cancers s’expliqueraient par des expositions professionnelles. Les travailleurs à risque comprennent ceux qui sont en contact avec le brai de houille et ceux qui travaillent dans le domaine de la gazéification du charbon et de la fabrication du caoutchouc, de l’aluminium, de l’auramine et du magenta (rouge d’aniline), de même que les coiffeurs pour hommes et femmes. Dans de nombreux pays, on a démontré l’influence des amines aromatiques dans la pathogenèse des cancers de la vessie à composante professionnelle. Dans cette classe de substances chimiques, on retient essentiellement la 2-naphthylamine, la benzidine, le 4-nitrobiphényle et la 3,3¢-dichlorobenzidine. Deux autres amines aromatiques, la 4,4¢-méthylènedianiline (MDA) et la 4,4¢-méthylènebis(2-chloraniline) (MOCA), comptent parmi les cancérogènes présumés pour la vessie les plus courants. Les informations sur les autres produits éventuellement cancérogènes auxquels sont exposés les travailleurs de l’industrie sont peu nombreuses, mais on sait que les amines aromatiques sont fréquemment présentes sur les lieux de travail.
L’intérêt suscité par les possibilités de dépistage du cancer de la vessie réside dans le fait qu’un diagnostic précoce, avant l’apparition de tout symptôme, devrait permettre de meilleurs succès curatifs. L’analyse cytologique d’échantillons d’urine après la miction et la recherche d’une hématurie ont été considérées comme des tests de dépistage potentiels. La question essentielle qui se pose lors de ces dépistages concerne la façon d’identifier les groupes à risque élevé et les individus très exposés au sein de ces groupes. Les études épidémiologiques permettent d’identifier les groupes à risque, tandis que les marqueurs biologiques devraient permettre d’isoler les individus particulièrement vulnérables dans ces groupes. D’une façon générale, le dépistage du cancer de la vessie dans le cadre de la médecine du travail, au moyen des tests d’hématurie et des tests de Papanicolaou, s’est jusqu’à présent révélé inefficace.
Une meilleure détection des cancers de la vessie devrait être rendue possible par le test sanguin «Hemastick 14 jours» décrit par Messing et son équipe. Chez 31 patients atteints de cancer de la vessie, ce test s’est révélé positif, à une reprise, au moins pour 84% d’entre eux et cela plus de deux mois avant le diagnostic cytoscopique. Ce test est grevé d’un taux de résultats faussement positifs de 16 à 20% et la moitié de ces personnes testées positives ne souffrent d’aucune maladie urologique. Son coût peu élevé pourrait le rendre utile dans un dépistage en deux étapes en association avec des marqueurs biologiques et l’analyse cytologique (Waples et Messing, 1992).
Dans une étude, l’anticorps monoclonal DD23 a permis, grâce à l’analyse quantitative par microscopie à fluorescence, de déceler un cancer de la vessie dans des cellules desquamées de l’épithélium urinaire. Une sensibilité de 85% et une spécificité de 95% ont pu être atteintes dans des cas de carcinomes à cellules transitionnelles peu ou très différenciés, y compris les tumeurs TaT1. L’antigène tumoral M344 combiné à la ploïdie d’ADN possède, en tant que marqueur, une sensibilité proche de 90%.
Des études indiquent que la meilleure démarche pourrait consister à associer des marqueurs biologiques aux tests d’hématurie. Le tableau 8.7 donne une liste récapitulative des applications de la cytologie urinaire par fluorescence quantitative conjuguée à l’emploi de marqueurs biologiques. Les changements cellulaires précoces de nature génétique, biochimique et morphologique, associés aux états précancéreux, sont la preuve que les individus à risque peuvent être identifiés des années avant qu’une néoplasie n’atteigne le stade patent. Le recours à des marqueurs biologiques de susceptibilité, associés à des marqueurs biologiques d’effet, devrait permettre d’identifier les personnes à risque avec une précision encore plus grande. Ces progrès ont été rendus possibles par les nouvelles techniques de quantification des altérations moléculaires phénotypiques et génotypiques au niveau cellulaire. L’évaluation du risque individuel facilitera la surveillance stratifiée de groupes d’individus sélectionnés qui bénéficieront d’une chimioprévention ciblée, et cela à des coûts peu élevés.
|
Dépistage des CIS 1 et des cancers de la vessie Monitorage de traitement chirurgical: Monitorage d’un traitement intravésical Sélection d’un traitement intravésical Monitorage de l’effet d’un traitement au laser Evaluation des patients présentant une hématurie Décision de la nécessité d’une cystoscopie Dépistage chez les populations à haut risque: Critère de décision pour: Autres indications: |
1 CIS: carcinomes in situ.
2 RTUCV: résection transurétrale de cancer de la vessie.
Source: Hemstreet et coll., 1996.
Les signes et symptômes du cancer de la vessie sont semblables à ceux des infections des voies urinaires et comprennent une douleur mictionnelle, une pollakiurie, ainsi que la présence de sang et de globules blancs dans l’urine. Etant donné que les symptômes d’une infection urinaire peuvent être les signes précurseurs d’un cancer de la vessie, surtout dans le cas d’une hématurie franche chez les patients d’un certain âge, le médecin se doit d’être vigilant et de vérifier la présence de bactéries dans l’urine. Tout patient en traitement pour infection urinaire sans signe d’amélioration immédiat doit être adressé à un urologue pour des examens complémentaires.
L’évaluation diagnostique d’un cancer de la vessie nécessite en premier lieu une urographie intraveineuse (UIV), afin d’exclure une maladie des voies urinaires hautes au niveau du bassinet du rein ou des uretères. La confirmation du cancer de la vessie nécessite un examen visuel au moyen d’un cystoscope à source lumineuse introduit par voie urétrale et des biopsies multiples qui permettront de déterminer si la tumeur est non invasive (par exemple, papillaire ou CIS) ou invasive. Des biopsies de la vessie et de l’urètre prostatique à l’aveugle peuvent contribuer à définir le stade de l’oncogenèse et les altérations locales. Les patients chez qui la tumeur n’est pas invasive doivent être surveillés étroitement, vu l’important risque de récurrence, bien qu’il soit rare d’assister à une progression du stade de la tumeur. Les patients chez qui le cancer de la vessie est déjà très différencié, ou chez qui la muqueuse ou la sous-muqueuse est envahie, courent un risque identique de récidive, mais ici, le passage à un stade supérieur est nettement plus probable. Ces patients reçoivent généralement des instillations intravésicales de produits immuno- ou chimiothérapeutiques après résection endoscopique. Lorsque la musculeuse ou la graisse périvésicale sont envahies, la situation est nettement plus suspecte d’extension tumorale métastatique et il est difficile de traiter de façon conservatrice. Cependant, même lorsqu’on procède à une cystectomie totale, traitement classique des cancers de la vessie avec envahissement musculaire, 20 à 60% des malades connaissent une issue fatale, presque toujours en raison de métastases. Si des métastases régionales ou à distance sont présentes lors du diagnostic, le taux de survie à cinq ans tombe à 35 et 9% respectivement, même après un traitement agressif. Le traitement du cancer de la vessie métastasé par chimiothérapie par voie générale fait des progrès et on rapporte des taux de succès complet de 30%. Des études indiquent qu’une chimiothérapie administrée avant même la cystectomie pourrait améliorer la survie chez certains patients.
La stadification des cancers de la vessie a une signification pronostique indéniable quant au potentiel de progression, de métastases ou de récidive dans 70% des cas. La détermination du stade tumoral exige généralement que l’on effectue un examen tomodensitométrique pour exclure des métastases hépatiques, une scintigraphie osseuse à isotope radioactif pour éliminer des métastases osseuses et une radiographie ou une tomodensitométrie pulmonaire pour exclure les métastases pulmonaires. La recherche de marqueurs et d’indices tumoraux qui permettraient de prédire quelles tumeurs vont probablement métastaser ou récidiver se poursuit. La possibilité d’accès aux cellules desquamées présentes dans l’urine postmictionnelle encourage à persévérer dans la voie des marqueurs biologiques cellulaires à des fins diagnostiques et préventives.