

Un acide minéral est un composé, formé d’hydrogène et d’un ou de plusieurs autres éléments (à l’exception du carbone), qui se dissocie ou se décompose pour donner des ions hydrogène par dissolution dans l’eau ou dans d’autres solvants. La solution ainsi obtenue présente certaines caractéristiques telles que l’aptitude à neutraliser des bases, à colorer le papier de tournesol en rouge et à produire des changements de couleur spécifiques avec certains autres indicateurs. Les acides minéraux sont souvent aussi appelés acides inorganiques. La forme anhydre peut être à l’état gazeux ou solide.
Un anhydride minéral est un oxyde de métalloïde qui peut se combiner avec l’eau pour former un acide inorganique. Il peut être produit soit par synthèse selon la réaction: S + O2 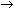 SO2, le produit obtenu pouvant être transformé en un acide par addition d’une molécule d’eau (hydratation), soit par élimination de l’eau à partir d’un acide, comme suit:
SO2, le produit obtenu pouvant être transformé en un acide par addition d’une molécule d’eau (hydratation), soit par élimination de l’eau à partir d’un acide, comme suit:
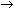 Mn2O7 + H2O
Mn2O7 + H2OLes anhydrides minéraux présentent généralement les propriétés biologiques des acides correspondants, étant donné que l’hydratation peut se produire facilement dans un milieu biologique aqueux.
Les acides minéraux sont utilisés comme intermédiaires ou comme catalyseurs dans les réactions chimiques. On les emploie dans diverses industries telles que le travail des métaux, l’industrie du bois, l’industrie textile, l’industrie des colorants et peintures, l’industrie du pétrole et la photographie. Dans le travail des métaux, ils sont souvent utilisés comme agents de décapage avant soudage, placage ou peinture. L’acide sulfamique, l’acide sulfurique et l’acide chlorhydrique sont employés en galvanoplastie et l’acide perchlorique sert dans le placage des métaux.
L’acide chlorhydrique, l’acide sulfurique, l’acide perchlorique et l’acide sulfamique ont de très nombreuses utilisations dans l’industrie. L’acide chlorhydrique, ou chlorure d’hydrogène en solution aqueuse, est employé pour les acidifications industrielles, l’affinage des minerais d’étain et de tantale, pour transformer l’amidon de maïs en sirop et pour éliminer le tartre des chauffe-eau et des échangeurs thermiques. Il est également utilisé pour le tannage des cuirs. L’acide sulfurique est employé dans la fabrication du papier, notamment du papier parchemin, et dans divers procédés comme le raffinage du pétrole et des huiles végétales, la carbonisation de la laine, l’extraction de l’uranium à partir de la pechblende et le décapage du fer et de l’acier. L’acide sulfurique et l’acide perchlorique interviennent dans l’industrie des explosifs. L’acide sulfamique sert d’ignifugeant dans les industries du bois et du textile et d’agent décolorant et bactéricide dans l’industrie du papier. Il est également utilisé pour la stabilisation du chlore dans les piscines.
L’acide nitrique entre dans la fabrication du nitrate d’ammonium pour les engrais et les explosifs. De plus, il est utilisé en synthèse organique, en métallurgie, dans la flottation des minerais et dans le retraitement du combustible nucléaire épuisé.
Les risques propres aux acides minéraux d’importance industrielle sont énumérés ci-après; cependant, il faut noter que tous ces acides ont en commun certaines propriétés dangereuses. En solution, ils ne sont pas inflammables mais, lorsqu’ils sont en contact avec certaines autres substances chimiques ou matières combustibles, ils peuvent provoquer une inflammation ou une explosion. Ces acides réagissent avec certains métaux en libérant de l’hydrogène, très inflammable et explosif lorsqu’il est mélangé avec de l’air ou de l’oxygène. Ils se comportent également comme des oxydants et réagissent violemment sur les matières organiques ou autres matières oxydables dont ils peuvent entraîner la destruction.
Risques pour la santé. Les acides minéraux sont corrosifs, surtout à forte concentration; s’ils entrent en contact avec la peau ou les muqueuses, ils détruisent les tissus biologiques et provoquent des brûlures chimiques. Le danger est très grand, notamment en cas d’atteinte oculaire. Les vapeurs ou les brouillards d’acides minéraux irritent les voies respiratoires et les muqueuses, encore que le degré d’irritation dépende dans une large mesure de la concentration de l’acide; on peut aussi observer une coloration anormale et une érosion des dents chez les travailleurs exposés à leur action. Le contact répété avec la peau peut causer des dermatites. L’ingestion accidentelle d’acides minéraux concentrés irrite gravement la gorge et l’estomac et, faute d’une intervention immédiate, elle peut entraîner une destruction des tissus des organes internes, dont l’issue peut être mortelle. Certains acides minéraux peuvent également se comporter comme des toxiques systémiques.
Dans la mesure du possible, il convient de remplacer les acides très corrosifs par d’autres, moins dangereux; en tout état de cause, il est essentiel de toujours recourir à la plus faible concentration compatible avec les exigences de l’opération. Partout où l’on utilise ces acides, des mesures de sécurité appropriées doivent être prises en ce qui concerne le stockage, la manutention, l’élimination des déchets, la ventilation, la protection individuelle et les premiers secours en cas d’accident.
Stockage. Eviter le contact avec d’autres acides ou matières combustibles ou oxydables. Les installations électriques doivent également résister aux acides.
Les aires de stockage doivent être séparées des autres bâtiments, être bien ventilées, protégées de la lumière solaire et d’autres sources de chaleur; les sols doivent être cimentés et ne contenir aucune substance pouvant réagir avec un acide. L’encuvement des gros réservoirs doit être réalisé au moyen d’un mur de protection et il faut installer un dispositif de neutralisation. Pour les urgences et les secours, il convient de prévoir à l’extérieur des locaux de stockage une bouche d’incendie et des appareils respiratoires autonomes. Les déversements doivent être traités immédiatement par arrosage au jet; en cas de fuites importantes, le personnel doit évacuer les locaux puis, muni de son équipement de secours, retourner sur les lieux pour neutraliser l’acide avec de l’eau ou du sable calciné. L’équipement électrique doit être imperméable à l’eau et résister aux acides. Un éclairage de sécurité est souhaitable.
Les récipients doivent être hermétiquement fermés et porter des étiquettes bien visibles indiquant leur contenu. On procédera à une décompression si nécessaire. La tuyauterie, les raccords, les garnitures et les vannes doivent être en matériau résistant à l’acide nitrique. Les récipients en verre ou en matière plastique seront convenablement protégés contre les chocs et placés à une certaine hauteur au-dessus du sol pour faciliter le lavage à grande eau en cas de fuite. Les fûts doivent être entreposés sur des berceaux ou des râteliers et calés. Les bouteilles contenant un acide anhydre à l’état gazeux seront stockées debout, avec leur capuchon de protection en place. Les récipients pleins doivent être entreposés de préférence séparément des vides. Il est essentiel que le matériel soit entretenu et que les locaux soient bien tenus et nettoyés.
Manutention. Dans la mesure du possible, les acides doivent être pompés à travers des systèmes clos afin de prévenir tout risque de contact. Lorsqu’il faut transporter ou transvaser un récipient, il importe d’utiliser pour cela un matériel approprié et de ne confier ce travail qu’à un personnel expérimenté. Le transvasement doit se faire à l’aide de siphons spéciaux, de pompes de transfert ou de berceaux basculants adaptés au transport des fûts ou des touries, etc. Les bouteilles d’acide anhydre à l’état gazeux doivent être pourvues de robinets et de raccords spéciaux.
Lorsqu’on mélange des acides avec de l’eau ou d’autres produits chimiques, les travailleurs chargés de l’opération doivent être parfaitement informés de tout risque de réaction violente ou dangereuse qui pourrait se produire. Par exemple, un acide concentré doit être versé lentement dans l’eau, et non le contraire, afin d’éviter un dégagement de chaleur excessif et les violentes réactions qui peuvent produire des éclaboussures sur la peau ou dans les yeux.
Ventilation. Lorsque des opérations produisent des brouillards ou des vapeurs d’acide, comme c’est le cas en galvanoplastie, un système d’aspiration doit être installé.
Protection individuelle. Les personnes exposées à des éclaboussures ou projections dangereuses d’acides minéraux doivent porter un équipement de protection individuelle résistant aux acides, protégeant les bras et les mains, les yeux et la face, ainsi qu’un tablier, une combinaison ou un surtout. Si l’on adopte des modes opératoires conformes aux impératifs de sécurité, l’utilisation d’appareils de protection respiratoire est en principe superflue; de tels appareils doivent cependant être disponibles pour les cas d’urgence, s’il se produit accidentellement un déversement ou une fuite.
Lorsque des travaux d’entretien ou de réparation nécessitent l’entrée du personnel dans des réservoirs qui ont contenu un acide minéral, ceux-ci doivent avoir été préalablement purgés et toutes les précautions nécessaires pour pénétrer dans un espace clos, telles que décrites ailleurs dans l’Encyclopédie, doivent être observées.
Formation. Tous les travailleurs qui sont amenés à manipuler des acides doivent être informés des dangers qu’ils comportent. Certaines activités, comme le travail dans un espace clos ou la manipulation de grandes quantités d’acides, doivent toujours être effectuées par deux personnes, l’une étant prête à porter secours à l’autre en cas de besoin.
Mesures d’hygiène. L’hygiène individuelle est d’une importance extrême partout où un contact avec des acides minéraux peut se produire. Des installations sanitaires appropriées devraient être à la disposition des travailleurs qui seront invités à se laver soigneusement avant les repas et à la fin du poste de travail.
Premiers secours. La contamination de la peau et des yeux par un acide minéral se traite essentiellement par un lavage immédiat et abondant à l’eau courante. Des douches d’urgence et des fontaines, bains ou flacons pour lavage oculaire doivent être installés aux emplacements où ils sont stratégiquement les plus utiles. Les projections dans les yeux seront traitées par lavage abondant avec de l’eau. Les vêtements contaminés doivent être ôtés et il convient de disposer d’autres moyens d’urgence appropriés pour le traitement de la peau, moyens que le personnel doit être entraîné à utiliser. La neutralisation de l’acide sur la zone touchée, au moyen d’une solution alcaline, telle que du bicarbonate de sodium à 2-3%, du carbonate de sodium à 5% et de l’hyposulfite de sodium à 5%, ou de la triéthanolamine à 10%, est une mesure normale.
Les personnes ayant inhalé des brouillards d’acide doivent être tout de suite éloignées de la zone contaminée et éviter tout effort. Elles doivent être vues immédiatement par un médecin. En cas d’ingestion accidentelle, il faut administrer à la victime une substance neutralisante et effectuer un lavage d’estomac. Généralement, il ne faut pas provoquer de vomissement, car cela pourrait contribuer à étendre les lésions.
Surveillance médicale. Les travailleurs doivent subir des examens médicaux à l’embauche, puis périodiques. L’examen médical à l’embauche doit mettre l’accent sur le dépistage des affections respiratoires chroniques, digestives ou nerveuses ou encore sur celles touchant les yeux et la peau. Des examens périodiques doivent être pratiqués à intervalles réguliers et comporter un contrôle dentaire.
Pollution de l’eau. Elle doit être évitée en prenant les mesures nécessaires pour que les eaux résiduaires contenant de l’acide usé ne soient pas déversées dans des cours d’eau ou le réseau d’égouts avant que le pH (acidité) ait été ramené à une valeur comprise entre 5,5 et 8,5.
Le chlorure d’hydrogène anhydre n’est pas corrosif; toutefois, ses solutions aqueuses attaquent pratiquement tous les métaux (le mercure, l’argent, l’or, le platine, le tantale et certains alliages constituent des exceptions) avec dégagement d’hydrogène. L’acide chlorhydrique réagit avec les sulfures pour former des chlorures et du sulfure d’hydrogène. C’est un composé remarquablement stable, mais à température élevée, il se décompose en chlore et en hydrogène.
Risques pour la santé. Les risques propres à l’acide chlorhydrique tiennent principalement à son action corrosive sur la peau et les muqueuses, à la formation d’hydrogène au contact de certains métaux et hydrures métalliques et à sa toxicité. L’acide chlorhydrique provoque des brûlures de la peau et des muqueuses, dont la gravité dépend de la concentration de la solution; ces brûlures peuvent conduire à des ulcérations entraînant des cicatrices chéloïdes et rétractiles. L’atteinte oculaire peut occasionner une perte d’acuité visuelle ou même la cécité. Les brûlures de la face peuvent produire des cicatrices importantes et défigurantes. Le contact fréquent avec des solutions aqueuses peut, à la longue, provoquer des dermatites.
Les vapeurs dégagées par cet acide irritent les voies respiratoires, provoquant laryngite, œdème de la glotte, bronchite, œdème pulmonaire, voire mort. Les atteintes digestives sont fréquentes et se caractérisent par une nécrose moléculaire des dents qui perdent leur éclat, virent au jaune, s’amollissent, s’appointissent et, enfin, se brisent.
Mesures de sécurité et de santé. Aux mesures générales décrites ci-dessus, il faut ajouter que l’acide ne doit pas être conservé à proximité de substances inflammables ou oxydantes, telles que l’acide nitrique ou les chlorates, ou à proximité de métaux ou d’hydrures métalliques qui peuvent être attaqués par cet acide avec formation d’hydrogène (les limites d’explosivité de l’hydrogène sont de 4 à 75% en volume dans l’air). Le matériel électrique doit être ignifugé et convenablement protégé contre la corrosion par les vapeurs.
L’acide nitrique est extrêmement corrosif; il attaque un grand nombre de métaux. La réaction avec l’acide nitrique et diverses substances organiques est souvent très fortement exothermique et explosive, et l’attaque des métaux s’accompagne parfois d’un dégagement de gaz toxiques. Au contact de la peau, il provoque des brûlures et ses vapeurs sont très irritantes pour la peau et les muqueuses; l’inhalation de volumes importants provoque une intoxication aiguë.
Incendies et explosions. A l’exception des métaux nobles (or, platine, iridium, thorium, tantale) et de certains alliages, l’acide nitrique attaque la plupart des substances et tous les métaux. Suivant la concentration de l’acide et la nature du métal, la réaction est plus ou moins rapide et donne naissance à différents gaz tels que des oxydes d’azote, de l’azote et de l’ammoniac, qui peuvent être toxiques ou suffocants. Avec le sodium ou le potassium, la réaction, violente et dangereuse, donne lieu à un dégagement d’azote. Avec certains métaux, toutefois, il se forme une pellicule protectrice d’oxyde qui prévient une attaque plus profonde. L’acide nitrique peut avoir une réaction explosive avec le sulfure d’hydrogène. Les nitrates obtenus par action de l’acide sur diverses bases sont de puissants agents oxydants.
Même en solution diluée, l’acide nitrique reste fortement oxydant. Les solutions ayant une concentration supérieure à 45% peuvent enflammer spontanément certaines matières organiques telles que l’essence de térébenthine, le bois, la paille, etc.
Risques pour la santé. Les solutions d’acide nitrique sont extrêmement corrosives et produisent des lésions de la peau, des yeux et des muqueuses, dont la gravité dépend de la durée de contact et de la concentration de l’acide; ces manifestations peuvent aller de l’irritation simple aux brûlures et à la nécrose locale si le contact est prolongé. Les vapeurs d’acide nitrique sont également corrosives pour la peau, les muqueuses et l’émail des dents.
Les vapeurs d’acide nitrique contiennent toujours une certaine proportion d’autres composés gazeux de l’azote (par exemple, des oxydes), qui varient en fonction de la concentration de l’acide et de la nature de l’opération. L’inhalation peut provoquer une intoxication aiguë ou suraiguë. L’intoxication suraiguë est tout à fait exceptionnelle et son évolution peut conduire à la mort. Quant à l’intoxication aiguë, elle comprend généralement trois phases: la première consiste en une irritation des voies aériennes supérieures (brûlures de la gorge, toux, sensation d’étouffement) et des muqueuses oculaires avec larmoiement; la seconde est trompeuse, car elle reste asymptomatique pendant une période pouvant aller jusqu’à plusieurs heures; dans la troisième, les troubles respiratoires réapparaissent et peuvent évoluer rapidement vers l’œdème pulmonaire aigu, de pronostic souvent sombre.
L’ingestion accidentelle cause des lésions graves au niveau de la cavité buccale, du pharynx, de l’œsophage et de l’estomac, et peut laisser de graves séquelles.
Mesures de sécurité et de santé. Suivant les quantités et les concentrations en cause, l’acide nitrique doit être conditionné dans des récipients en acier inoxydable, en aluminium ou en verre. Les touries en verre doivent être protégées par une enveloppe métallique qui offre une grande résistance aux chocs. Toutefois, si l’acide nitrique contient des composés fluorés, les récipients en verre sont à éviter. Les matières organiques telles que le bois, la paille, la sciure et autres doivent être maintenues à distance des opérations impliquant de l’acide nitrique. Lorsque l’acide nitrique doit être dilué avec de l’eau, c’est l’acide qui doit être versé dans l’eau et tout chauffage localisé doit être évité.
L’acide sulfurique est un acide fort qui, chauffé à plus de 30 °C, émet des vapeurs et, au-delà de 200 °C, dégage de l’anhydride sulfurique (trioxyde de soufre). A froid, il attaque tous les métaux, y compris le platine; à chaud, sa réactivité est renforcée. Dilué, il dissout l’aluminium, le chrome, le cobalt, le cuivre, le fer, le manganèse, le nickel et le zinc, mais ni le plomb ni le mercure. Ayant une grande affinité pour l’eau, il absorbe l’humidité atmosphérique et carbonise les matières organiques par déshydratation. Il déplace de leurs sels tous les autres acides, sauf l’acide silicique.
L’acide sulfurique existe à l’état naturel au voisinage des volcans, notamment dans les fumerolles.
Risques pour la santé. L’action de l’acide sulfurique sur l’organisme est celle d’un puissant produit caustique et d’un toxique général. Introduit dans l’organisme à l’état liquide ou sous forme de vapeur, il exerce une action fortement irritante et provoque des brûlures chimiques au niveau des muqueuses respiratoire et digestive, des dents, des yeux et de la peau. Au contact de la peau, l’acide sulfurique provoque une violente déshydratation. Il libère une chaleur suffisante pour produire des brûlures qui s’apparentent à des brûlures thermiques et peuvent être classées comme elles, à savoir du premier, deuxième ou troisième degré. Les lésions produites sont plus ou moins profondes suivant la concentration de l’acide et la durée du contact. L’inhalation des vapeurs se traduit par les symptômes suivants: sécrétion nasale, éternuements, sensation de brûlure à la gorge et dans la région rétrosternale; par la suite, on observe de la toux, une gêne respiratoire, accompagnée parfois de spasmes des cordes vocales, une sensation de brûlure aux yeux avec larmoiement et congestion des conjonctives. Les fortes concentrations peuvent provoquer une sécrétion sanglante du nez, l’apparition de sang dans les crachats, une hématémèse, une gastrite et autres symptômes. Les lésions dentaires sont fréquentes; elles affectent principalement les incisives et se manifestent par des taches brunâtres, une striation de l’émail, des caries et la destruction rapide et indolore de la couronne dentaire.
L’exposition professionnelle à de fortes vapeurs d’acides minéraux, telles que les vapeurs d’acide sulfurique, a été classée par le Centre international de recherche sur le cancer (CIRC) comme cancérogène pour l’être humain.
Les brûlures chimiques sont l’atteinte la plus fréquente observée par le personnel affecté à la production d’acide sulfurique. Les solutions concentrées provoquent des brûlures profondes des muqueuses et de la peau; au début, la zone de contact avec l’acide blanchit, puis devient brune avant d’évoluer vers une ulcération bien définie sur un fond rouge clair. Ces lésions sont longues à guérir, laissant souvent des cicatrices étendues qui entraînent des gênes fonctionnelles. Si la brûlure couvre une trop grande surface cutanée, l’issue peut en être mortelle. Le contact répété avec de faibles concentrations d’acide dessèche la peau et cause des ulcérations aux mains et, sur le pourtour des ongles, des panaris ou des inflammations purulentes chroniques. Les projections d’acide dans les yeux ont des conséquences particulièrement nocives: ulcération profonde de la cornée, kératoconjonctivite et lésions palpébrales aux séquelles graves.
L’action toxique générale de l’acide sulfurique consiste en une déplétion alcaline (c’est-à-dire une acidose dont les symptômes neurologiques sont de l’agitation, une démarche hésitante et une faiblesse générale).
Mesures de sécurité et de santé. Les mesures de prévention les plus efficaces consistent à opérer en vase clos et à mécaniser la manipulation, ce qui élimine tout contact direct du personnel avec l’acide sulfurique. Le stockage de l’acide, les modalités de stockage, de manutention et d’application, la ventilation et l’éclairage des lieux de travail, l’entretien et la propreté ainsi que les moyens de protection individuelle méritent à cet égard la plus grande attention; en plus des précautions générales indiquées ci-dessus, l’acide sulfurique ne doit pas être stocké à proximité de chromates, chlorates ou autres substances similaires, en raison des risques d’incendie et d’explosion.
Incendies et explosions. L’acide sulfurique et l’oléum ne sont pas inflammables en eux-mêmes. Néanmoins, ils réagissent vigoureusement avec de nombreuses substances, en particulier organiques, en libérant une quantité de chaleur suffisante pour provoquer, le cas échéant, leur inflammation ou leur explosion; de plus, l’hydrogène dégagé lors de la réaction avec des métaux peut former dans l’air un mélange explosif.
Catalyseurs. Dans le procédé de contact où le catalyseur est un dérivé du vanadium, il y a lieu de protéger le personnel contre les dégagements de vanadate d’ammonium ou de pentoxyde de vanadium, que l’on utilise sur un support de diatomite ou de gel de silice.
|
Nom chimique |
Synonymes et numéro ONU |
Numéro CAS |
Formule chimique |
|
Acide borique |
Acide orthoborique; acide boracique |
|
B(OH)3 |
|
Acide chlorhydrique |
Acide chlorhydrique anhydre; chlorure d’hydrogène; acide muriatique (vx) |
|
HCl |
|
Acide chlorosulfurique |
Acide chlorosulfonique; acide monochlorosulfurique; monochlorure d’acide sulfonique; chlorohydrine sulfurique |
|
HClSO3 |
|
Acide fluoroborique |
Acide borofluorique; acide fluoborique; tétrafluoroborate d’hydrogène; acide tétrafluoroborique |
|
HBF4 |
|
Acide fluorosulfurique |
Acide fluorosulfonique; acide fluosulfonique |
|
HFSO3 |
|
Acide nitrique |
Eau-forte; acide azotique |
|
HNO3 |
|
Acide perchlorique |
Acide perchlorique |
|
HClO4 |
|
Acide phosphorique |
Acide orthophosphorique |
|
H3PO4 |
|
Acide silicique |
Acide métasilicique; précipité de silice; gel de silice |
|
H2SiO3 |
|
Acide sulfamique |
Acide amidosulfonique; acide amidosulfurique |
|
NH2SO3H |
|
Acide sulfurique |
Sulfate de dihydrogène |
|
H2SO4 |
|
Nom chimique et numéro CAS |
Fiches internationales de sécurité chimique (ICSC) |
NIOSH |
||||
|
Exposition de courte durée |
Exposition de longue durée |
Voies d’exposition |
Symptômes |
Organes cibles et voies de pénétration |
Symptômes |
|
|
Acide chlorhydrique |
Yeux; peau; voies respiratoires; poumons |
Poumons; dents |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse, essoufflement, mal de gorge; les symptômes peuvent être retardés |
Voies respiratoires; yeux; peau Inhalation; ingestion; contact |
Irritation du nez, de la gorge et du larynx; toux; étouffement; dermatite; en solution: brûlures oculaires et cutanées; sous forme de liquide: gelures; chez l’animal: spasmes du larynx; œdème pulmonaire |
|
Acide nitrique |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse, perte de conscience; les symptômes peuvent être retardés |
Yeux; voies respiratoires; peau; dents Inhalation, ingestion; contact |
Irritation des yeux, de la peau et des muqueuses; œdème pulmonaire retardé; pneumopathie; bronchite; érosion dentaire |
||
|
Acide phosphorique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Sensation de brûlure, toux, respiration laborieuse, essoufflement, mal de gorge, perte de conscience |
Voies respiratoires; yeux; peau |
Irritation des yeux, de la peau et des voies aériennes supérieures; brûlures oculaires et cutanées; dermatite |
|
|
Acide sulfamique |
Yeux; peau; voies respiratoires; poumons |
|||||
|
Acide sulfurique |
Yeux; peau; voies respiratoires; poumons |
Inhalation |
Corrosion, sensation de brûlure, toux, respiration laborieuse, mal de gorge |
Voies respiratoires; yeux; peau; dents |
Irritation des yeux, de la peau, du nez et de la gorge; œdème pulmonaire; bronchite; emphysème; conjonctivite; stomatite; érosion dentaire; trachéobronchite; brûlures oculaires et cutanées; dermatite |
|
|
Nom chimique et numéro CAS |
Risques physiques |
Risques chimiques |
Classification ONU/ risques subsidiaires |
|
Acide chlorhydrique |
Gaz plus lourd que l’air |
La solution aqueuse est un acide fort qui réagit violemment avec les bases et qui est corrosif. Réagit violemment avec les oxydants pour donner un gaz toxique (chlore). Au contact de l’air, émet des vapeurs corrosives (acide chlorhydrique). Attaque de nombreux métaux pour former un gaz combustible (hydrogène) |
8 |
|
Acide chlorosulfurique |
8 |
||
|
Acide fluoroborique |
8 |
||
|
Acide fluorosulfurique |
8 |
||
|
Acide nitrique |
Se décompose par chauffage pour donner des oxydes d’azote. Oxydant énergique qui réagit violemment avec les matières combustibles et réductrices (térébenthine, charbon, alcool). Acide fort qui réagit violemment avec les bases et qui attaque les métaux. Réagit très violemment sur les produits chimiques organiques (acétone, acide acétique, anhydride acétique) avec risque d’incendie et d’explosion. Attaque certains plastiques |
8 |
|
|
Acide perchlorique |
5.1/8 |
||
|
Acide phosphorique |
Polymérise énergiquement en présence de dérivés azoïques et d’époxydes ou d’autres substances polymérisables. Non combustible à haute température, mais forme des vapeurs toxiques (oxydes de phosphore). Se décompose au contact de métaux, d’alcools, d’aldéhydes, de cyanures, de cétones, de phénols, d’esters, de sulfures, d’organohalogènes, en produisant des vapeurs toxiques. Acide moyennement fort. Attaque les métaux pour libérer de l’hydrogène inflammable |
8 |
|
|
Acide sulfamique |
8 |
||
|
Acide sulfurique |
A toute température, il se dégage des vapeurs toxiques (oxydes de soufre). Oxydant énergique. Réagit énergiquement avec les matières combustibles et réductrices. Acide fort qui réagit énergiquement avec les bases. Attaque la plupart des métaux communs en formant un gaz inflammable et explosif (hydrogène). Réagit énergiquement avec l’eau et les matériaux organiques en dégageant de la chaleur. Des vapeurs toxiques ou irritantes (ou des gaz) se forment par chauffage (oxydes de soufre) |
8 |
|
Nom chimique et numéro CAS |
Couleur/ aspect |
Point d’ébullition (°C) |
Point de fusion (°C) |
Masse moléculaire (g/mol) |
Solubilité dans l’eau |
Densité (eau = 1) |
Densité de vapeur (air = 1) |
Tension de vapeur (kPa) |
Limites d’explosibilité (%) |
Point d’éclair (°C) |
Température d’auto- inflammation (°C) |
|
Acide borique |
Cristaux incolores, transparents, granulés ou poudre blancs |
300* |
171 |
61,83 |
Soluble |
1,435 |
~0 |
||||
|
Acide chlorhydrique |
Liquide incolore |
–85 |
–115 à –114 |
36,46 |
Très soluble |
1,00-1,49 |
1,27 |
4220* |
|||
|
Acide chlorosulfurique |
Liquide incolore ou légèrement jaune |
151-152 |
–80 |
116,52 |
Réaction |
1,75-1,77 |
4,02 |
0,13 Pa |
|||
|
Acide fluoroborique |
Liquide incolore |
130 (décomposition) |
87,81 |
Très soluble |
1,84 |
3,0 |
0,66 |
||||
|
Acide fluorosulfurique |
Liquide incolore; brun rougeâtre avec l’acétone |
163 |
–89 |
100,07 |
Réaction |
1,726 |
3,3-37,7* |
||||
|
Acide nitrique |
Liquide limpide, incolore ou jaunâtre |
83 |
–42 à –41 |
63,01 |
Très soluble |
1,50-1,55 |
2-2 |
3,5-6,4 |
|||
|
Acide perchlorique |
Incolore, liquide huileux |
~90 |
–112 |
100,46 |
Soluble |
1,70-1,77 |
3,5 |
||||
|
Acide phosphorique |
Cristaux orthorhombiques instables ou liquide sirupeux; à 20 °C, les concentrés à 50% et 75% sont des liquides mobiles, ceux à 85% sont sirupeux et l’acide à 100% est sous forme de cristaux; liquide visqueux, incolore, inodore |
407* |
42-43 |
98,00 |
Très soluble |
1,83-1,90 |
3,4 |
4,0 Pa |
|||
|
Acide silicique |
Précipité gélatineux obtenu lorsque la solution de silicate de sodium est acidifiée; durant le séchage, se transforme en une poudre blanche amorphe |
78,10 |
Insoluble |
||||||||
|
Acide sulfamique |
Cristaux orthorhombiques; solide blanc cristallin |
205 (décomposition) |
97,09 |
Soluble |
2,13-2,15 |
3,3 |
0,75 Pa |
||||
|
Acide sulfurique |
Limpide, incolore, liquide huileux si pur, mais brunâtre si impur |
280-340 |
10-11 |
98,08 |
Très soluble |
1,83-1,84 |
3,4 |
0,13 à 146°C |