

Les méthodes d’hygiène du travail se bornent à mesurer les produits chimiques qui contaminent l’air ambiant aux postes de travail et à maîtriser les risques qu’ils présentent; les autres aspects de la toxicité des substances présentes dans l’environnement (absorption cutanée, ingestion et expositions extraprofessionnelles) échappent à leur contrôle. La surveillance biologique contribue à combler cette lacune.
En 1980, la surveillance biologique a fait l’objet d’un séminaire organisé à Luxembourg, sous le parrainage conjoint de la Communauté économique européenne (CEE) et de deux organismes américains: l’Institut national de la sécurité et de la santé au travail (National Institute for Occupational Safety and Health (NIOSH)) et l’Administration de la sécurité et de la santé au travail (Occupational Safety and Health Administration (OSHA), (Berlin, Yodaiken et Henman, 1984). A cette occasion, la surveillance biologique a été définie comme étant la mesure et l’évaluation des agents chimiques ou de leurs métabolites dans les tissus, les sécrétions, les excrétions ou l’air expiré ou toute combinaison de ces méthodes, afin d’estimer l’exposition des personnes et les risques pour leur santé par rapport à une référence appropriée. La surveillance est un acte répétitif, régulier et préventif qui doit conduire à des mesures de correction si nécessaire; elle ne saurait être confondue avec une démarche diagnostique.
La surveillance biologique constitue l’une des trois grandes démarches suivies pour prévenir les maladies liées à la présence d’agents toxiques dans l’environnement général ou professionnel, les deux autres étant les contrôles d’ambiance et la surveillance de la santé des travailleurs.
La séquence de développement d’une pathologie peut être schématisée de la manière suivante: source — exposition à un agent chimique — dose interne — effet biochimique ou cellulaire (réversible) — répercussions sur la santé — pathologie. La figure 27.1 montre les relations existant entre surveillance de l’environnement, surveillance biologique, surveillance de l’exposition et surveillance de la santé des travailleurs.
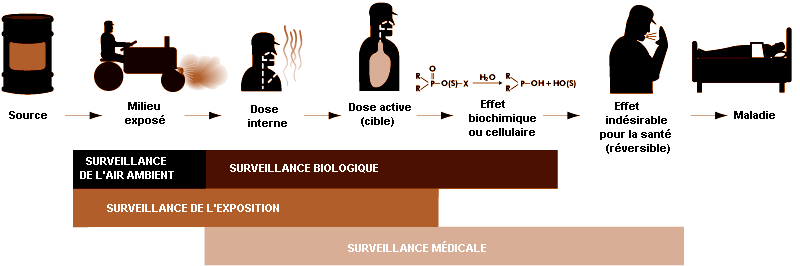
Lorsqu’une substance toxique, un produit chimique industriel par exemple, est présente dans l’environnement, elle contamine l’air, l’eau, la nourriture ou les surfaces en contact avec la peau; la quantité de produits toxiques dans ces milieux est évaluée par les contrôles d’ambiance.
Une fois le produit toxique absorbé, distribué, métabolisé et excrété, une certaine dose interne (quantité absolue de polluant absorbée ou ayant pénétré dans l’organisme pendant un intervalle de temps donné) est effectivement présente dans l’organisme et peut être décelée dans les liquides biologiques. Les effets biochimiques ou cellulaires sont dus à l’interaction du produit toxique avec un récepteur au niveau d’un organe cible (organe qui, dans des conditions d’exposition spécifiques, présente la réaction indésirable initiale ou la plus importante). La surveillance biologique permet d’évaluer la dose interne et de mettre en évidence ses effets au niveau biochimique et cellulaire.
La surveillance de la santé des travailleurs a été définie lors du même séminaire CEE/NIOSH/OSHA en 1980 comme étant le suivi médico-physiologique régulier des travailleurs exposés, dans le but de protéger leur santé et de prévenir l’apparition d’une maladie.
La surveillance biologique et celle de la santé des travailleurs font partie d’un continuum qui va du dosage des agents chimiques ou de leurs métabolites dans l’organisme à la détection des signes précoces d’atteinte réversible d’un organe cible, grâce à l’évaluation des effets biochimiques et cellulaires. La détection d’une maladie installée reste en dehors du champ de ces évaluations.
La surveillance biologique peut être subdivisée en deux parties: a) la surveillance de l’exposition; b) la surveillance de l’effet induit, ces deux démarches reposant respectivement sur des indicateurs de dose interne et des indicateurs d’effet.
L’objectif de la surveillance biologique de l’exposition consiste à quantifier la dose interne d’un produit chimique donné, afin d’estimer la charge corporelle biologiquement active et d’évaluer ainsi le risque pour la santé. Il s’agit de s’assurer que l’exposition professionnelle n’atteint pas un niveau susceptible d’avoir des effets nocifs. Un effet est dit «nocif» s’il entraîne une altération des capacités fonctionnelles, une moindre aptitude à compenser une situation de stress ou à maintenir l’homéostasie (état d’équilibre stable de l’organisme), ou encore une plus grande sensibilité à d’autres facteurs présents dans l’environnement.
Selon le produit chimique et le paramètre biologique étudié, le terme de dose interne peut avoir plusieurs acceptions (Bernard et Lauwerys, 1987). Il peut s’agir tout d’abord de la quantité de produit chimique récemment absorbée, par exemple, pendant un poste de travail. Cette quantité est mesurée par dosage de la concentration du polluant dans l’air alvéolaire ou dans le sang au cours de cette période ou encore le lendemain (les échantillons de sang ou d’air alvéolaire pouvant être prélevés jusqu’à 16 heures après l’exposition). S’agissant d’un produit chimique ayant une demi-vie biologique longue (par exemple, les métaux dans le sang), la dose interne peut refléter la quantité absorbée sur une période de plusieurs mois.
Dans une autre acception, la dose interne peut aussi représenter la quantité de produit chimique accumulée dans l’organisme. Dans ce dernier cas, elle constitue un indicateur d’accumulation du produit, servant à estimer l’importance de la fixation dans les organes ou les tissus à partir desquels ce produit sera lentement éliminé. Il en est ainsi, par exemple, des dosages sanguins du DDT ou du PCB.
Enfin, la dose interne peut indiquer la quantité de produit chimique présente au site d’action, et donc renseigner sur la dose biologiquement active. L’une des utilisations prometteuses de cette dernière approche est la détermination des adduits formés par les produits chimiques toxiques avec la protéine de l’hémoglobine ou avec l’ADN.
La surveillance biologique de l’effet induit a pour objectif de mettre en évidence les altérations précoces et réversibles au niveau d’un organe cible et d’identifier, à cette occasion, les individus présentant des signes d’effets pathologiques. Dans cette optique, la surveillance biologique de l’effet induit représente donc un outil essentiel pour la surveillance de la santé des travailleurs.
La surveillance biologique de l’exposition à des produits chimiques fait appel à des indicateurs de dose interne qui mesurent les paramètres suivants:
Les facteurs influant sur la concentration d’un produit chimique et de ses métabolites dans le sang ou l’urine sont traités plus loin dans le présent chapitre.
S’agissant de la concentration dans l’air alvéolaire, plusieurs paramètres sont à prendre en considération outre le niveau d’exposition dans l’air ambiant: la solubilité et le métabolisme des substances inhalées, la ventilation pulmonaire, le débit cardiaque et la durée d’exposition (Brugnone et coll., 1980).
L’utilisation des adduits à l’ADN et à l’hémoglobine pour surveiller l’exposition humaine aux substances ayant un potentiel cancérogène constitue une technique promise à un bel avenir pour les expositions à de faibles concentrations de produits. Il est bon de rappeler que les substances qui se lient aux macromolécules dans l’organisme humain ne sont pas toutes génotoxiques, ni donc potentiellement cancérogènes. La formation d’adduits représente seulement une étape dans le processus complexe de la cancérogenèse. D’autres processus cellulaires, comme la promotion et la progression de la réparation de l’ADN, contribuent sans aucun doute à moduler le risque de développement d’une pathologie telle que le cancer. A l’heure actuelle, la technique de détermination des adduits devrait être réservée exclusivement à la surveillance de l’exposition aux produits chimiques. Cette question est traitée de façon plus détaillée dans l’article intitulé «Les produits chimiques génotoxiques», du présent chapitre.
La surveillance biologique de l’effet induit est assurée grâce à l’établissement d’indicateurs d’effet capables d’identifier les modifications précoces et encore réversibles. Cette approche permet d’estimer indirectement la quantité de produit chimique liée aux sites d’action et d’évaluer précocement les altérations fonctionnelles de l’organe cible.
Malheureusement, seuls quelques exemples illustrent actuellement cette approche, notamment: 1) l’inhibition de la pseudocholinestérase par les insecticides organophosphorés; 2) l’inhibition de l’acide delta-aminolévulinique déshydratase (ALAD) par le plomb inorganique; 3) l’augmentation de l’excrétion urinaire de l’acide D-glucarique et des porphyrines chez les sujets exposés soit à des produits induisant les enzymes microsomales, soit à des agents porphyrinogènes (par exemple, hydrocarbures chlorés).
Pour les substances dont la toxicité s’exerce après pénétration dans l’organisme humain, la surveillance biologique permet d’évaluer plus précisément et plus spécifiquement les risques pour la santé que ne le font les contrôles d’ambiance. Un paramètre biologique reflétant la dose interne apporte en effet davantage d’informations sur les effets systémiques nocifs qu’un contrôle de l’air ambiant.
Par rapport à la surveillance de l’air, la surveillance biologique offre de nombreux avantages puisqu’elle permet en particulier d’évaluer:
Malgré ces avantages, la surveillance biologique souffre encore aujourd’hui de limites importantes:
La programmation d’une surveillance biologique ne peut être envisagée que si les conditions élémentaires suivantes sont réunies:
Dans ce contexte, la validité d’un test est l’aptitude du para- mètre considéré à prédire la situation effective (telle qu’on l’attendrait d’un instrument de mesure très précis). La validité est déterminée par la résultante de deux caractéristiques: sensibilité et spécificité. Les tests dotés d’une grande sensibilité donnent peu de faux négatifs, ceux qui sont très spécifiques donnant peu de faux positifs (CCE, 1983; 1984; 1986; 1987; 1988a; 1988b; 1989).
L’étude de la concentration d’une substance en milieu de travail et le mesurage simultané des indicateurs de dose et des indicateurs d’effet chez les sujets exposés permettent de connaître les relations entre exposition professionnelle, concentrations de la substance dans les milieux biologiques et répercussions précoces de l’exposition.
La connaissance du rapport qui existe entre la dose d’une substance et l’effet induit est indispensable à la mise en œuvre d’un programme de surveillance biologique. Cette relation dose-effet est évaluée par l’analyse de la corrélation entre l’indicateur de dose et l’indicateur d’effet, ainsi que par l’étude des variations quantitatives qu’accuse l’indicateur d’effet pour chaque variation de l’indicateur de dose (voir les commentaires détaillés sur la relation dose-effet dans le chapitre no 33 «La toxicologie»).
L’étude de la relation dose-effet permet de définir la concentration de substance toxique pour laquelle l’indicateur d’effet dépasse les valeurs considérées actuellement comme étant sans danger. Elle pourrait aussi permettre de déterminer la concentration sans effet.
Etant donné que tous les individus d’un groupe ne réagissent pas de la même manière, il est nécessaire de tenir compte de cette relation dose-réponse, autrement dit d’étudier la réponse du groupe à une exposition en examinant l’effet observé en fonction de la dose interne. Le terme de réponse renvoie au pourcentage de sujets du groupe qui présentent, pour chaque dose, une variation quantitative spécifique d’un indicateur d’effet.
Avant d’appliquer un programme de surveillance biologique, il est indispensable de connaître: 1) le comportement des indicateurs utilisés en fonction de l’exposition, en particulier de ceux qui caractérisent le degré, la constance et la durée de l’exposition; 2) l’intervalle de temps entre la fin de l’exposition et le mesurage des indicateurs; 3) tous les facteurs physiologiques et pathologiques étrangers à l’exposition et susceptibles de modifier les valeurs des indicateurs.
Les articles qui suivent illustrent le comportement d’un certain nombre d’indicateurs biologiques de dose ou d’effet, utilisés dans le cadre de la surveillance de l’exposition professionnelle à des substances industrielles d’usage courant. Pour chaque substance, on évaluera l’utilité pratique de cette approche et ses limites et, plus particulièrement, le moment des prélèvements d’échantillons et les facteurs d’interférence. Ces considérations sont indispensables pour établir les critères de sélection d’un test biologique.
Le choix du moment où l’on effectue le prélèvement dépend des caractéristiques cinétiques du produit; il est essentiel de connaître notamment le mode d’absorption de la substance (voie pulmonaire, gastro-intestinale ou cutanée), sa distribution dans les différents compartiments de l’organisme, sa biotransformation et son élimination. Il est également important de savoir si la substance peut s’accumuler ou non dans le corps.
En cas d’exposition à des substances organiques, le moment du recueil des échantillons biologiques est d’autant plus important que les processus métaboliques en cause se déroulent à des vitesses différentes, d’où une excrétion plus ou moins rapide de la dose absorbée.
Pour utiliser correctement les indicateurs biologiques, il est indispensable de bien connaître les facteurs qui, bien qu’indépendants de l’exposition, peuvent avoir une influence sur les valeurs de ces indicateurs (Alessio, Berlin et Foà, 1987).
Ainsi, des paramètres physiologiques tels que le régime alimentaire, le sexe et l’âge peuvent modifier les résultats obtenus. La consommation de poisson ou de crustacés peut faire augmenter les taux urinaires d’arsenic ou les taux sanguins de mercure. Pour une même valeur de plombémie, les taux de protoporphyrine érythrocytaire sont significativement plus élevés chez les femmes que chez les hommes. Enfin, la concentration urinaire de cadmium augmente avec l’âge.
S’agissant du mode de vie, le tabagisme et la consommation d’alcool sont des facteurs d’interférence particulièrement importants. Le tabagisme peut en effet entraîner l’absorption directe des substances naturellement présentes dans les feuilles de tabac (par exemple, cadmium), des polluants du milieu de travail déposés sur les cigarettes (par exemple, plomb), ou encore des produits de combustion (par exemple, monoxyde de carbone).
La consommation d’alcool peut, elle aussi, influer sur les indicateurs biologiques. Ainsi, le plomb est naturellement présent dans les boissons alcoolisées, et les grands buveurs présentent une plombémie accrue. L’ingestion d’alcool peut aussi interférer avec la biotransformation et l’élimination des toxiques industriels. Une dose unique d’alcool peut inhiber le métabolisme de nombreux solvants dont le trichloroéthylène, le xylène, le styrène et le toluène, par suite de la concurrence métabolique que l’alcool éthy-lique et ces solvants peuvent se livrer pour des enzymes de dégradation indispensables. L’ingestion régulière d’alcool peut, quant à elle, influencer le métabolisme des solvants d’une tout autre manière, c’est-à-dire en accélérant leur biotransformation, selon toute vraisemblance par induction du système d’oxydation microsomal. L’alcool étant la substance la plus susceptible d’induire une interférence métabolique, il est recommandé de déterminer les indicateurs d’exposition aux solvants en dehors de toute consommation alcoolique.
On connaît moins bien les effets possibles des médicaments sur les valeurs des indicateurs biologiques. Il a été montré que l’aspirine peut interférer avec la biotransformation du xylène en acide méthylhippurique; le phénylsalicylate, médicament très employé comme analgésique, peut causer une augmentation importante des taux de phénol urinaires. Quant aux préparations antiacides à base d’aluminium, elles peuvent entraîner une élévation des taux plasmatiques et urinaires d’aluminium.
Le métabolisme des solvants usuels tels que le toluène, le xylène, le trichloroéthylène, le tétrachloroéthylène et le méthylchloroforme varie sensiblement d’un groupe ethnique à l’autre.
Certains états pathologiques peuvent aussi avoir une incidence sur les valeurs des indicateurs biologiques. L’organe cible peut ainsi répondre anormalement aux tests de surveillance biologique, soit du fait de l’action spécifique de l’agent toxique en cause, soit pour d’autres raisons. L’évolution des concentrations urinaires de cadmium est un bon exemple du premier type d’anomalie. En effet, une fois que les lésions tubulaires dues au cadmium sont constituées, l’excrétion urinaire de ce métal augmente notablement et ne reflète plus le degré d’exposition. Un exemple du second type d’anomalie est l’augmentation des taux de protoporphyrine érythrocytaire observée au cours des carences en fer, en l’absence de toute absorption particulière de plomb.
Les variations physiologiques des prélèvements utilisés pour mesurer un indicateur biologique (urine, par exemple) peuvent avoir une incidence sur le résultat d’un test. Pour des raisons pratiques, seuls des échantillons urinaires ponctuels peuvent être recueillis en milieu de travail, alors même que les variations de densité de l’urine au cours de la journée entraînent une forte fluctuation des valeurs de l’indicateur mesuré.
Pour éviter cet écueil, il est conseillé d’éliminer les échantillons urinaires trop dilués ou trop concentrés, en fixant des valeurs limites pour la densité urinaire ou la créatinine. Dans la pratique, on écarte les échantillons urinaires ayant une densité inférieure à 1 010 ou supérieure à 1 030, ou dont la teneur en créatinine est inférieure à 0,5 g/l ou supérieure à 3,0 g/l. Plusieurs auteurs préconisent aussi d’ajuster les valeurs des indicateurs à la densité urinaire ou encore d’exprimer les résultats en les rapportant à la créatinine urinaire.
Les variations pathologiques des milieux biologiques peuvent aussi modifier considérablement la valeur d’un indicateur biologique. Ainsi, chez un sujet anémique exposé à un métal (mercure, cadmium, plomb, etc.), la concentration sanguine de ce métal peut être inférieure à la valeur attendue compte tenu de l’exposition, par suite de la diminution du nombre d’hématies circulantes transportant le métal toxique.
Le dosage dans le sang total de substances toxiques ou de métabolites liés aux globules rouges devrait donc toujours être assorti de la détermination de l’hématocrite pour connaître le pourcentage du volume globulaire par rapport au volume sanguin.
En cas d’exposition simultanée à plusieurs substances toxiques sur un lieu de travail, des interférences métaboliques peuvent survenir et modifier le comportement des indicateurs biologiques, et donc donner lieu à de sérieux problèmes d’interprétation. C’est ainsi que des études effectuées chez l’humain ont montré des interférences lors d’expositions associant, des substances comme toluène et xylène, xylène et éthylbenzène, toluène et benzène, hexane et méthyléthylcétone ou encore tétrachloroéthylène et trichloroéthylène.
Lorsque la biotransformation d’un solvant est inhibée, l’excrétion urinaire de son métabolite diminue (sous-estimation possible du risque), alors que la concentration du solvant augmente dans le sang ou dans l’air expiré (surestimation possible du risque).
Ainsi, lorsque le dosage simultané des substances et de leurs métabolites est possible, il peut être utile, pour évaluer le degré d’inhibition métabolique, de s’assurer que l’on ne se trouve pas en présence à la fois de concentrations urinaires de métabolites plus basses que prévues et de concentrations accrues de solvants dans le sang ou l’air expiré.
Des interférences métaboliques ont été décrites alors que chacune des substances était présente à une concentration proche de la valeur limite couramment acceptée, voire parfois à une concentration inférieure. En général, on n’observe cependant pas d’interférences lorsque la concentration de chaque substance est faible.
En santé au travail, les indicateurs biologiques sont utilisés à plusieurs fins, et notamment: 1) la surveillance périodique individuelle des travailleurs; 2) l’analyse de l’exposition de groupes de travailleurs; 3) les études épidémiologiques. Les tests employés devraient présenter des caractéristiques de précision, d’exactitude, de sensibilité et de spécificité telles que la fréquence des erreurs de classification soit minime.
Une valeur de référence correspond à la valeur d’un indicateur biologique dans la population générale non exposée professionnellement à la substance toxique étudiée. On se reportera à ces valeurs pour interpréter les résultats obtenus lors des programmes de surveillance biologique dans une population présumée exposée. Ces valeurs de référence ne devraient pas être confondues avec les valeurs limites, qui sont généralement des directives ou des limites légales établies pour les expositions professionnelles ou environnementales (Alessio et coll., 1992).
Lorsqu’on doit comparer les résultats d’analyses dans un groupe, il est indispensable de connaître la distribution des valeurs dans le groupe de référence et dans le groupe étudié avant de procéder à l’analyse statistique. Il est essentiel de comparer le groupe exposé à un groupe de référence dont le sexe, l’âge, le mode de vie et les habitudes alimentaires sont semblables.
Afin d’obtenir des valeurs de référence fiables, il faut bien s’assurer que les sujets du groupe de référence n’ont jamais été exposés aux substances toxiques soit dans le cadre de leur activité professionnelle, soit en raison d’une pollution particulière.
Pour évaluer l’exposition à une substance toxique, il faut aussi prendre soin de ne pas inclure des sujets qui, sans être directement exposés à cette substance, travaillent sur le même site. En effet, s’ils étaient exposés indirectement, les résultats du groupe exposé en seraient sous-estimés.
Une autre pratique à éviter, et qui est pourtant répandue, est le recours à des valeurs de référence publiées dans des travaux réalisés dans d’autres pays et souvent dans des régions où les conditions de pollution de l’environnement sont différentes.
Les contrôles périodiques sont obligatoires lorsque la concentration d’une substance toxique sur un lieu de travail est proche de la valeur limite. Il est recommandé de mesurer si possible à la fois un indicateur d’exposition et un indicateur d’effet. Les résultats ainsi obtenus seront comparés aux valeurs de référence et aux valeurs limites recommandées pour la substance étudiée (ACGIH, 1995).
L’analyse d’un groupe de travailleurs s’impose lorsque les résultats des indicateurs biologiques utilisés risquent d’être fortement influencés par des facteurs indépendants de l’exposition (régime alimentaire, concentration ou dilution de l’urine, etc.) et lorsque la fourchette des valeurs «normales» est large.
Pour garantir l’utilité des résultats, il faut que le groupe soit suffisamment important et homogène par rapport à un certain nombre de critères: exposition aux produits, sexe et, dans le cas de certains agents toxiques, ancienneté au poste de travail. Plus les niveaux d’exposition sont constants, plus les résultats obtenus seront fiables. Une étude effectuée sur des travailleurs qui changent souvent de service ou d’activité n’aura pas une très grande valeur. Enfin, pour qu’une étude de ce type puisse être évaluée correctement, il ne suffit pas d’exprimer les résultats sous forme de moyennes et de fourchettes: il convient aussi de prendre en compte la distribution de fréquence des valeurs de l’indicateur biologique choisi.
Outre les applications susmentionnées, les résultats de la surveillance biologique de groupes de travailleurs peuvent aussi être utilisés dans des études épidémiologiques transversales ou prospectives.
Les études transversales peuvent servir à comparer les expositions dans les différents services d’une usine ou dans des branches d’activité diverses, afin de dresser une cartographie des risques des processus de fabrication. Pour ce type d’application, les contrôles de qualité interlaboratoires ne sont malheureusement pas encore suffisamment répandus et il n’est donc pas certain que les résultats soient comparables d’un laboratoire à l’autre.
Les études prospectives permettent d’analyser les variations des niveaux d’exposition afin de vérifier, par exemple, l’efficacité des améliorations apportées ou de corréler sur plusieurs années les indicateurs biologiques et l’état de santé des sujets suivis. Les résultats de ce type d’études de longue durée sont très utiles pour résoudre les problèmes qui évoluent avec le temps. A l’heure actuelle, la surveillance biologique sert ainsi surtout à vérifier que l’exposition à un moment donné ne comporte pas de risque, mais ne présente qu’un intérêt relatif dans le cas d’expositions de longue durée. Un niveau d’exposition actuellement jugé comme sans danger pourrait fort bien ne plus être considéré comme tel dans le futur.
L’application de la surveillance biologique à l’évaluation d’une toxicité potentielle pose des problèmes d’ordre éthique. L’un des objectifs de cette surveillance consiste en effet à rassembler suffisamment d’informations pour définir le seuil à partir duquel un effet donné doit être considéré comme nocif; si l’information est insuffisante, toute perturbation sera considérée comme indésirable. Les conséquences réglementaires et légales de ce type d’informations doivent être évaluées et discutées pour parvenir à un consensus social sur la meilleure utilisation possible des indicateurs biologiques. En d’autres termes, il est indispensable que les travailleurs, les employeurs, les collectivités et les autorités compétentes pour légiférer soient formés à l’interprétation des résultats de la surveillance biologique, celle-ci ne devant être ni trop alarmiste ni trop complaisante.
Les résultats des tests et leur interprétation devraient être communiqués aux personnes concernées selon les modalités prévues. Tous les participants devraient être clairement informés du caractère expérimental ou non des indicateurs utilisés.
Le Code international d’éthique pour les professionnels de la santé au travail, établi en 1992 par la Commission internationale de la santé au travail, spécifie que «les tests biologiques et les autres investigations doivent être choisis en fonction de leur adéquation à assurer la protection de la santé du travailleur concerné en tenant dûment compte de leur sensibilité, de leur spécificité et de leur valeur prédictive». Les tests «qui ne sont pas fidèles ou qui n’ont pas une valeur prédictive suffisante en relation avec les exigences du poste» ne devraient pas être utilisés (voir texte du Code dans le chapitre no 19, «Les questions d’éthique»).
La surveillance biologique ne peut être effectuée que sur un nombre limité de polluants en raison du manque de données de référence. Il en résulte que son application à l’évaluation des expositions reste très limitée.
L’Organisation mondiale de la santé (OMS), pour sa part, propose des valeurs de référence à visée sanitaire uniquement pour le plomb, le mercure et le cadmium, valeurs qu’elle définit comme étant les taux sanguins et urinaires n’entraînant aucun effet nocif décelable. La Conférence américaine des hygiénistes gouvernementaux du travail (American Conference of Gouvernmental Industrial Hygienists (ACGIH)), quant à elle, a établi des indices biologiques d’exposition (BEI) qui permettent d’évaluer le degré d’exposition globale aux produits chimiques industriels. Or, l’ACGIH n’a défini de tels indices que pour 26 composés (ACGIH, 1995).
Les décisions concernant la santé, le bien-être et l’aptitude au travail, de même que la position de l’employeur sur les questions de sécurité et de santé, doivent être fondées sur des données de qualité. La surveillance biologique doit répondre à cette exigence. Il est de la responsabilité de tout laboratoire analysant des échantillons biologiques prélevés sur des populations de salariés de s’assurer de la fiabilité, de l’exactitude et de la précision des résultats. Cette responsabilité va de la mise à disposition de techniques et d’instructions aux fins du prélèvement d’échantillons à la communication correcte des résultats au professionnel de santé responsable du suivi de chaque personne. Tous ces aspects font partie du concept d’assurance qualité.
Le rôle essentiel d’un programme d’assurance qualité est le contrôle et le maintien de l’exactitude et de la précision analytiques. Les laboratoires de surveillance biologique ont souvent été mis en place dans un environnement clinique et ont tout naturellement adopté les principes et les techniques d’assurance qualité qui ont cours en biologie clinique. Les dosages sanguins ou urinaires des substances toxiques et la mesure des indicateurs ne sont en effet pas fondamentalement différents des méthodes qui sont employées en biologie clinique ou dans les laboratoires de pharmacologie clinique des grands hôpitaux.
Un programme d’assurance qualité débute pour l’analyste par le choix et la mise en œuvre d’une méthode adaptée. Dans un deuxième temps, on met en place une procédure de contrôle interne de la qualité dont le rôle est d’assurer la précision. Le laboratoire doit ensuite vérifier l’exactitude de l’analyse, ce qui peut s’effectuer grâce à une évaluation externe de la qualité (voir ci-après). Il faut souligner cependant que l’assurance qualité va bien au-delà de ces seuls aspects du contrôle de la qualité analytique.
De nombreux textes traitent des méthodes analytiques applicables à la surveillance biologique. Ils constituent un guide certes utile, mais ne dispensent pas l’analyste de tous les efforts nécessaires pour parvenir à des résultats de bonne qualité. L’élaboration d’un protocole constitue l’élément central de tout programme d’assurance qualité. Ce protocole doit décrire en détail les parties de la méthode qui ont le plus d’impact sur la fiabilité, l’exactitude et la précision. L’accréditation par les Etats des laboratoires de biologie clinique, de toxicologie ou de médecine légale dépend, au demeurant, de la qualité des protocoles élaborés par ces laboratoires. Le développement d’un protocole est un processus géné- ralement très long. Aussi, lorsqu’un laboratoire désire mettre au point une nouvelle méthodologie, il est souvent plus rentable pour lui d’adopter un protocole ayant fait ses preuves dans un autre laboratoire et déjà validé, par exemple, dans le cadre d’un programme international d’assurance qualité. Dans la pratique, si un laboratoire veut employer une technique analytique spécifique telle que la chromatographie en phase gazeuse plutôt que la chromatographie liquide à haute performance, il a des chances de trouver un laboratoire connu pour la qualité de ses résultats et utilisant déjà cette méthode analytique. Les coordonnées des laboratoires de référence peuvent être trouvées dans les publications spécialisées ou auprès des organisateurs de programmes nationaux d’assurance qualité.
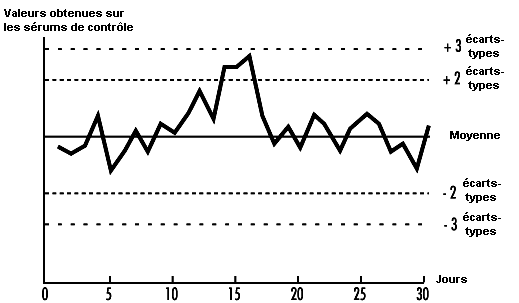
La qualité des résultats analytiques obtenus dépend de la précision de la méthode mise en œuvre, celle-ci étant à son tour fonction du respect scrupuleux du protocole établi. Le meilleur mode d’évaluation de la précision passe par l’introduction «d’échantillons de contrôle qualité», à intervalles réguliers au cours d’un cycle analytique. Ainsi, pour le contrôle du dosage de la plombémie, on prévoit des échantillons de contrôle qualité tous les six à huit échantillons testés. Avec des méthodes analytiques plus stables, on peut introduire un nombre moins important d’échantillons de contrôle dans chaque série d’analyses. Les échantillons de contrôle qualité pour le dosage de la plombémie sont préparés à partir de 500 ml de sang (humain ou bovin) additionné de plomb inorganique; des parties aliquotes sont conservées à basse température (Bullock, Smith et Whitehead, 1986). Avant d’utiliser un nouveau lot d’échantillons de contrôle qualité, 20 aliquotes sont analysées lors de séries analytiques distinctes afin de déterminer la moyenne et l’écart-type du lot (Whitehead, 1977), ces deux chiffres servant à tracer le diagramme de contrôle de Shewhart (voir figure 27.2). Les résultats de l’analyse des échantillons de contrôle qualité inclus dans des séries successives sont portés sur ce diagramme. L’analyste applique ensuite les règles d’acceptation ou de rejet de la série analytique selon que les résultats se situent dans les limites de deux ou trois écarts-types par rapport à la moyenne. Westgard et coll. (1981) ont établi des règles, validées par modélisation sur ordinateur, qui sont applicables aux échantillons de contrôle. De nombreux ouvrages de biologie clinique décrivent cette démarche de contrôle qualité. Whitehead (1977) présente une introduction simplifiée à l’assurance qualité. Il faut souligner que la validité des techniques de contrôle qualité repose sur la préparation et l’analyse des échantillons de contrôle, indépendamment des échantillons utilisés pour l’étalonnage.
Cette approche présente l’avantage d’être adaptée à de nombreux dosages pratiqués pour la surveillance biologique. Des lots d’échantillons de sang ou d’urine peuvent être préparés par addition de la substance toxique ou du métabolite à doser. De même, le sang total, le sérum, le plasma ou l’urine peuvent être fractionnés en parties aliquotes et conservés au congélateur ou lyophilisés en vue du dosage des enzymes ou des protéines. L’analyste doit bien évidemment prendre soin d’éviter tout risque infectieux lors de la manipulation d’échantillons de sang humain.
Le premier volet d’un programme d’assurance qualité est la parfaite adhésion à un protocole bien défini et le respect de règles d’acceptabilité. Tout laboratoire peut être appelé à fournir des explications sur sa procédure de contrôle et d’assurance qualité aux professionnels de la santé qui font appel à ses services. Il lui appartient donc d’effectuer des recherches sur les résultats inhabituels ou inattendus.
Une fois que le laboratoire s’est assuré de la précision de ses résultats, il lui reste à en confirmer l’exactitude, c’est-à-dire le rapport entre la quantité trouvée et celle effectivement présente dans l’échantillon. Il s’agit d’une opération difficile pour le laboratoire, mais qu’il a la liberté d’effectuer en participant à un programme de qualité externe. Ces programmes, désormais courants pour les laboratoires de biologie clinique, sont encore peu répandus en surveillance biologique, sauf dans le cas des contrôles de plombémie, pour laquelle il existe de telles initiatives depuis les années soixante-dix (Bullock, Smith et Whitehead, 1986). La comparaison des résultats analytiques et de ceux d’autres laboratoires qui ont analysé des échantillons du même lot permet d’évaluer les résultats et de se faire une idée du niveau d’exactitude. Il existe plusieurs programmes nationaux et internationaux d’évaluation de la qualité. La plupart d’entre eux acceptent volontiers l’adhésion de nouveaux laboratoires, car la validité de la moyenne des résultats augmente avec le nombre de participants (la moyenne peut alors être assimilée à la concentration réelle). Les programmes qui comptent de nombreux participants sont aussi mieux à même d’évaluer les performances d’un laboratoire en fonction des méthodes analytiques employées et de conseiller l’emploi d’autres méthodes pour remplacer celles qui sont moins performantes. Dans certains pays, la participation à ce type de programmes est un critère important pour l’accréditation d’un laboratoire. L’Organisation mondiale de la santé a publié des directives concernant l’organisation et la mise en œuvre de ces programmes d’évaluation externe de la qualité (OMS, 1982a).
En l’absence de programmes de ce type, on peut évaluer l’exactitude des résultats au moyen de produits de référence homologués qui existent pour un nombre limité de substances et que l’on peut se procurer dans le commerce. Les échantillons distribués dans le cadre des programmes d’évaluation externe présentent plusieurs avantages: 1) l’analyste ne connaît pas le résultat par avance; 2) les échantillons correspondent à une fourchette de concentrations; 3) le matériel nécessaire reste d’un coût abordable puisqu’il n’est pas nécessaire de recourir à des méthodes analytiques très complexes.
Tous les efforts déployés par un laboratoire pour atteindre l’exac-titude et la précision voulues resteront vains si les échantillons n’ont pas été prélevés au bon moment, s’ils sont contaminés, s’ils ont été détériorés pendant le transport, ou s’ils ont été mal étiquetés. Il est également peu défendable de soumettre des personnes à des prélèvements invasifs sans prendre soin du matériel biologique prélevé. Le laboratoire n’est pas toujours directement responsable des prélèvements; l’assurance qualité d’un programme de surveillance biologique n’en doit pas moins prendre ces facteurs en compte. Le laboratoire devrait ainsi s’assurer que les seringues et les flacons fournis pour les prélèvements ne sont pas contaminés et devrait donner des instructions claires sur la technique de prélèvement et sur la conservation et le transport des échantillons. L’importance du moment du prélèvement, pendant le poste ou la semaine de travail, et ses conséquences sur la toxicocinétique sont maintenant bien reconnues (ACGIH, 1995; HSE, 1992); les professionnels de la santé responsables des prélèvements devraient donc en être informés.
Des résultats d’excellente qualité analytique ne présenteront pas grand intérêt pour l’individu concerné ou le professionnel de la santé s’ils ne sont pas communiqués à celui-ci en temps utile et sous une forme interprétable. Tout laboratoire de surveillance biologique devrait donc instaurer des procédures qui permettent d’alerter en temps utile le professionnel intéressé en cas de résultat anormal, inattendu ou surprenant, afin de lui donner la possibilité de prendre rapidement les mesures qui s’imposent. L’interprétation des résultats de laboratoire, notamment des variations de concentration entre plusieurs échantillons successifs, dépend souvent de la connaissance de la précision du dosage. Dans l’optique d’une qualité totale qui va du prélèvement à la présentation des résultats, les professionnels de la santé devraient être informés de la précision et de l’exactitude des résultats, de même que de la fourchette de référence, des limites recommandées et des limites réglementaires, pour être mieux à même d’interpréter les résultats.
Les métaux et les composés organométalliques toxiques (alumi-nium, antimoine, arsenic minéral, béryllium, cadmium, chrome, cobalt, mercure métallique et ses sels, nickel, composés organo-mercuriels, plomb, plomb alkylé, sélénium et vanadium) sont connus depuis longtemps pour leurs risques potentiels sur la santé des sujets exposés. Des études épidémiologiques portant sur la relation entre la dose interne et l’effet induit, ou la réponse observée chez des personnes exposées professionnellement à certains de ces toxiques, ont abouti à la proposition de valeurs limites biologiques à visée sanitaire (voir tableau 27.1).
|
Métaux |
Echantillons |
Valeurs de référence1 * |
Limites de l’ACGIH (BEI)2 |
Limites de la DFG (BAT)3 |
Limites de L. & H. (TMPC)4 |
|
Aluminium |
Sérum/plasma |
<1 µg/100 ml |
|
|
|
|
Antimoine |
Urine |
<1 µg/g |
|
|
35 µg/g (fin de poste) |
|
Arsenic |
Urine (arsenic inorganique + métabolites méthylés) |
<10 µg/g |
50 µg/g (fin de semaine de travail) |
|
50 µg/g (si moyenne pondérée en fonction du temps = 0,05 mg/m3) et 30 µg/g (si moyenne pondérée en fonction du temps = 0,01 mg/m3) (fin de poste) |
|
Béryllium |
Urine |
<2 µg/g |
|
|
|
|
Cadmium |
Sang |
<0,5 µg/100 ml |
0,5 µg/100 ml |
1,5 µg/100 ml |
0,5 µg/100 ml |
|
Chrome |
Sérum/plasma |
<0,05 µg/100 ml |
|
|
|
|
Cobalt |
Sérum/plasma |
<0,05 µg/100 ml |
|
|
|
|
Manganèse |
Sang |
<1 µg/100 ml |
|
|
|
|
Mercure inorganique |
Sang |
<1 µg/100 ml |
1,5 µg/100 ml (fin de poste, fin de semaine de travail) |
5 µg/100 ml |
2 µg/100 ml (fin |
|
Nickel |
Sérum/plasma |
<0,05 µg/100 ml |
|
|
|
|
Plomb |
Sang (plomb) |
<25 µg/100 ml |
30 µg/100 ml |
femmes <45 ans: 30 µg/100 ml |
40 µg/100 ml |
|
Sélénium |
Sérum/plasma |
<15 µg/100 ml |
|
|
|
|
Vanadium |
Sérum/plasma |
<0,2 µg/100 ml |
|
|
|
* Concentrations urinaires par gramme de créatine. ** EKA = équivalents d'exposition pour les produits cancérogènes.
1 Lauwerys et Hoet, 1993 (avec quelques modifications). 2 BEI = indices biologiques d'exposition recommandés par l'ACGIH (1997). 3 BAT = limites de tolérance biologique recommandées par la DFG (1996). 4 TMPC = concentrations maximales admissibles proposées par Lauwerys et Hoet (1993).
La précision et l’exactitude des dosages de métaux dans les milieux biologiques sont rendues difficiles en raison des très faibles concentrations présentes dans ces milieux. Lorsque la surveillance biologique s’effectue par prélèvements urinaires, comme c’est souvent le cas, il s’agit généralement d’échantillons ponctuels pour lesquels on devra effectuer une correction tenant compte de la dilution de l’urine. La méthode normalisée la plus fréquemment utilisée consiste à exprimer les résultats par gramme de créatinine. Les analyses effectuées sur des échantillons d’urine trop diluée ou trop concentrée ne sont pas fiables et devraient être répétées.
Dans l’industrie, les travailleurs peuvent être exposés aux composés d’aluminium minéral par voie inhalatoire et aux poussières contenant de l’aluminium par ingestion. L’aluminium est peu absorbé par voie orale, mais son absorption est augmentée par l’administration simultanée de citrates. Le taux d’absorption de l’aluminium déposé dans les poumons n’est pas connu, la biodisponibilité dépendant selon toute vraisemblance des caractéristiques physico-chimiques des particules. L’urine est la principale voie d’excrétion de l’aluminium absorbé. Les concentrations sériques et urinaires d’aluminium dépendent à la fois de l’intensité de l’exposition récente et de la charge corporelle en aluminium. Chez les personnes non exposées professionnellement, la concentration sérique d’aluminium est habituellement inférieure à 1 µg/100 ml et dépasse rarement 30 µg/g de créatinine dans l’urine. Chez les sujets à fonction rénale normale, l’excrétion urinaire d’aluminium est un indicateur d’exposition plus sensible que la concentration sérique ou plasmatique.
Des études effectuées chez des soudeurs donnent à penser que la cinétique d’excrétion urinaire de l’aluminium passe par un mécanisme à deux étapes, dont la première correspond à une demi-vie biologique d’environ 8 heures. Chez les personnes exposées depuis plusieurs années, le métal s’accumule dans l’organisme et les concentrations sériques et urinaires dépendent aussi de la charge corporelle. L’aluminium s’accumule dans différents compartiments de l’organisme d’où il est excrété sur plusieurs années à des vitesses variables. Une forte accumulation d’aluminium (os, foie, cerveau) a aussi été observée chez des patients atteints d’insuffisance rénale. Les malades sous dialyse risquent une toxicité osseuse ou une encéphalopathie lorsque leur taux sérique d’aluminium dépasse 20 µg/100 ml, mais il est possible d’observer des signes de toxicité à des concentrations inférieures. Pour prévenir les intoxications par l’aluminium, la Commission des Communautés européennes recommande que la concentration plasmatique reste constamment inférieure à 20 µg/100 ml, toute concentration supérieure à 10 µg/100 ml devant conduire à augmenter la fréquence de la surveillance biologique et de la surveillance de la santé des travailleurs, et les concentrations supérieures à 6 µg/100 ml devant être considérées comme le signe évident d’une charge corporelle excessive.
L’antimoine inorganique peut pénétrer dans l’organisme par ingestion ou inhalation, mais son taux d’absorption n’est pas connu. Les composés pentavalents absorbés sont excrétés principalement par voie urinaire, les composés trivalents par les fèces. Une rétention de composés antimoniques après une exposition de longue durée est possible. Les concentrations sériques et urinaires normales en antimoine sont probablement inférieures à 0,1 µg/100 ml et 1 µg/g de créatinine, respectivement.
Une étude préliminaire chez des travailleurs exposés à de l’antimoine pentavalent sur leur lieu de travail montre qu’une exposition moyenne de 0,5 mg/m3, pondérée en fonction du temps, entraînerait une élévation de la concentration urinaire pouvant atteindre 35 µg/g de créatinine au cours d’un poste de travail.
L’arsenic minéral peut pénétrer dans l’organisme par les voies gastro-intestinale et respiratoire. L’arsenic absorbé est principalement éliminé par le rein, soit sous forme inchangée, soit après méthylation. L’arsenic inorganique est également excrété par la bile sous forme de complexe avec le glutathion.
Dans le cas d’une exposition orale unique à une faible dose d’arséniate, 25% et 45% de la dose administrée sont excrétés par voie urinaire en 1 et 4 jours, respectivement.
Après exposition à l’arsenic trivalent ou pentavalent, l’excrétion urinaire est constituée de 10 à 20% d’arsenic inorganique, 10 à 20% d’acide monométhylarsonique et 60 à 80% d’acide cacodylique. Après exposition professionnelle à de l’arsenic inorganique, la proportion des espèces arsenicales dans l’urine dépend du moment du prélèvement des échantillons.
Les organo-arsenicaux présents dans les organismes marins sont aussi facilement absorbés par le tube digestif, mais ils sont excrétés en majeure partie sous forme inchangée.
Les effets toxiques à long terme de l’arsenic (y compris les effets génotoxiques) sont le fait principalement de l’exposition à l’arsenic minéral. La surveillance biologique a donc pour but d’évaluer l’exposition aux composés arsenicaux inorganiques. La méthode de choix est le dosage spécifique de l’arsenic inorganique (As), de l’acide monométhylarsonique (MMA) et de l’acide cacodylique (DMA) dans l’urine. Cependant, étant donné que la consommation de fruits de mer peut influer sur les taux d’excrétion du DMA, les personnes soumises à un dépistage devraient s’abstenir d’en consommer au cours des 48 heures précédant la collecte des urines.
Chez les personnes qui ne sont pas exposées professionnellement à l’arsenic inorganique et qui n’ont pas consommé de fruits de mer récemment, la somme des trois espèces arsenicales n’excède pas en principe 10 µg/g de créatinine urinaire. Des valeurs plus élevées peuvent être trouvées dans les zones géographiques où les eaux de boisson contiennent des quantités importantes d’arsenic.
On estime que, en l’absence de consommation de fruits de mer, l’exposition moyenne (pondérée en fonction du temps) à 50 et 200 µg/m3 d’arsenic inorganique conduit à des concentrations urinaires moyennes d’As, de MMA et de DMA (somme des métabolites) de respectivement 54 et 88 µg/g de créatinine à la fin d’un poste de travail.
En cas d’exposition à des composés arsenicaux inorganiques moins solubles (arséniure de gallium, par exemple), l’arsenic urinaire reflète la quantité absorbée, mais non la dose totale délivrée à l’organisme (poumons, tractus gastro-intestinal).
L’arsenic capillaire est un bon marqueur de la quantité d’arsenic inorganique absorbée pendant la période de croissance du cheveu. L’arsenic organique d’origine marine ne paraît pas être capté par les cheveux au même degré que l’arsenic inorganique. Le mesurage de l’arsenic inorganique sur la longueur d’un cheveu peut renseigner valablement sur le moment et la durée de l’exposition. Cependant, ce type de dosage n’est pas recommandé lorsque l’air ambiant est contaminé par de l’arsenic, car il n’est alors pas possible de faire la distinction entre l’arsenic endogène et l’arsenic exogène déposé sur les cheveux. Les taux d’arsenic dans les cheveux sont habituellement inférieurs à 1 mg/kg. L’arsenic dans les ongles a la même signification que l’arsenic dans les cheveux.
Les concentrations sanguines d’arsenic, de même que les concentrations urinaires, reflètent la quantité d’arsenic récemment absorbée, mais la relation entre l’intensité de l’exposition et la concentration sanguine est encore mal connue.
L’inhalation est la principale voie d’entrée du béryllium chez les sujets de par leur travail exposés. L’exposition de longue durée peut entraîner une accumulation importante dans les tissus pulmonaires et le squelette, qui est le site ultime de stockage. L’élimination du béryllium absorbé a lieu essentiellement par voie uri- naire et, à un moindre degré, par les fèces.
Les concentrations de béryllium peuvent être mesurées dans le sang et l’urine, mais ces analyses ne sont encore utilisées que de manière qualitative pour confirmer une exposition au métal, car on connaît mal la relation entre les expositions récentes au béryllium et les quantités stockées dans l’organisme. Il est par ailleurs difficile d’interpréter les quelques données publiées sur l’excrétion de béryllium chez les personnes exposées, parce que le mesurage de l’exposition externe n’est généralement pas effectué comme il conviendrait, et que la sensibilité et la précision des méthodes analytiques utilisées sont variables. Les concentrations urinaires et sériques normales de béryllium sont vraisemblablement inférieures à 2 µg/g de créatinine et 0,03 µg/100 ml, respectivement.
Cependant, la mise en évidence d’une concentration urinaire normale de béryllium ne permet pas d’exclure la possibilité d’une exposition antérieure. En effet, l’excrétion urinaire de béryllium n’est pas toujours accrue dans ce cas, même chez les sujets qui ont développé une granulomatose pulmonaire, c’est-à-dire une maladie caractérisée par la présence dans les poumons de multiples granulomes (nodules de tissu inflammatoire).
Sur le lieu de travail, l’absorption de cadmium a lieu principalement par voie inhalatoire, bien que l’absorption gastro-intestinale puisse aussi contribuer de façon non négligeable à la dose interne. Le cadmium se caractérise par une longue demi-vie biologique, qui est supérieure à dix ans. Il est principalement lié à la métallothionéine dans les tissus et aux globules rouges dans le sang. En raison de l’accumulation possible du cadmium dans l’organisme, tout programme de surveillance biologique de groupes exposés chroniquement à ce métal devrait tenter d’évaluer à la fois l’exposition actuelle et passée.
Il est aujourd’hui possible de mesurer in vivo les quantités de cadmium accumulées dans les principaux sites de stockage (reins et foie) par activité neutronique. Cette technique n’est cependant pas utilisée en routine et la surveillance de la santé des travailleurs, de même que les études à grande échelle sur la population générale reposent sur une évaluation indirecte de l’expo- sition par dosage du métal dans l’urine et le sang.
La cinétique précise du cadmium chez l’humain n’est pas encore totalement élucidée, mais certaines conclusions ont été formulées à des fins pratiques dans le cas du cadmium sanguin et urinaire. Chez les personnes exposées au cadmium depuis peu, les taux sanguins augmentent progressivement pour atteindre une concentration proportionnelle à l’intensité de l’exposition au bout de quatre à six mois. Chez celles qui sont exposées au cadmium depuis longtemps, la concentration sanguine reflète surtout l’absorption moyenne intervenue durant les derniers mois. L’influence relative de la charge corporelle en cadmium sur les taux sanguins peut être plus importante chez les sujets qui ont accumulé une grande quantité de cadmium mais qui n’y sont plus exposés. Lorsque l’exposition au cadmium cesse, la concentration sanguine diminue relativement vite, avec une demi-vie initiale de deux à trois mois. Selon la charge corporelle, la concentration peut cependant rester supérieure à celle des sujets témoins. D’après des études effectuées chez l’humain et chez l’animal, la concentration urinaire de cadmium peut être interprétée de la manière suivante: en dehors des cas de surexposition aiguë au cadmium, et tant que la capacité de stockage du cortex rénal n’est pas saturée ou que le cadmium n’a pas provoqué de néphropathie, la concentration urinaire de cadmium augmente progressive-ment en proportion de la quantité de cadmium stockée dans les reins. Dans les conditions qui sont prévalentes dans la population générale et chez les travailleurs exposés à des concentrations modérées, on note une corrélation significative entre le cadmium urinaire et le cadmium tissulaire rénal. Si l’exposition a été excessive, les sites de fixation du cadmium dans l’organisme se saturent progressivement et la concentration dans le cortex rénal cesse d’augmenter même si l’exposition se poursuit. A partir de ce stade, le cadmium absorbé ne peut plus être retenu dans cet organe et il est rapidement excrété dans l’urine. La concentration urinaire dépend alors à la fois de la charge corporelle et des quantités récemment absorbées. Si l’exposition continue, certains sujets peuvent développer des lésions rénales, qui s’accompagnent d’une nouvelle élévation du cadmium urinaire due à la libération du cadmium stocké dans les reins et à une moindre réabsorption du cadmium circulant. Après un épisode d’exposition aiguë, les concentrations urinaires de ce produit peuvent cependant augmenter rapidement de manière passagère sans pour autant refléter une élévation de la charge corporelle.
Des études récentes montrent que la métallothionéine urinaire a la même signification biologique que le cadmium urinaire. Une bonne corrélation a été observée entre les concentrations urinaires de métallothionéine et de cadmium, indépendamment de l’intensité de l’exposition et de l’état de la fonction rénale.
Les concentrations sanguines et urinaires normales de cadmium sont habituellement inférieures à 0,5 µg/100 ml et 2 µg/g de créatinine, respectivement, et sont plus élevées chez les fumeurs. Chez les travailleurs exposés pendant de longues périodes, le risque de troubles rénaux est négligeable tant que les concentrations urinaires de cadmium n’excèdent pas 10 mg/g de créatinine. Toute accumulation de cadmium dans l’organisme conduisant à une excrétion urinaire supérieure à cette valeur devrait donc être prévenue. Des résultats semblent cependant indiquer que certains marqueurs rénaux (dont la signification pour la santé n’est pas encore élucidée) présentent des variations anormales pour des taux urinaires de cadmium situés entre 3 et 5 mg/g de créatinine; il semble donc raisonnable de proposer une limite biologique de 5 mg/g de créatinine. Dans le sang, la limite biologique de 0,5 mg/100 ml a été préconisée pour les expositions de longue durée. Dans la population générale exposée au cadmium par l’alimentation ou le tabagisme, ou lors du vieillissement par suite de la diminution normale de la fonction rénale, il est cependant possible que la concentration critique dans le cortex rénal soit plus faible.
La toxicité du chrome est surtout due à ses composés hexavalents dont l’absorption est relativement plus élevée que celle des composés trivalents. L’élimination se fait pour l’essentiel par voie urinaire.
Chez les individus non exposés au chrome de par leur travail, les concentrations sériques et urinaires de chrome n’excèdent d’ordinaire pas 0,05 µg/100 ml et 2 µg/g de créatinine, respectivement. L’exposition récente à des sels solubles de chrome hexavalent (chez les galvanoplastes ou les soudeurs sur acier inoxy- dable, par exemple) peut être évaluée par la surveillance des taux urinaires de chrome à la fin du poste de travail. Des études effectuées par plusieurs auteurs montrent que l’exposition moyenne (pondérée en fonction du temps) à 0,025 ou 0,05 mg/m3 de chrome hexavalent correspond respectivement à une concentration moyenne de 15 ou 30 µg/g de créatinine en fin de période d’exposition. Cette relation n’est toutefois valable qu’à l’échelle d’un groupe de personnes. Après exposition à 0,025 mg/m3 de chrome hexavalent, la limite inférieure de l’intervalle de confiance à 95% est d’environ 5 µg/g de créatinine. Une autre étude réalisée chez des soudeurs sur acier inoxydable a montré qu’une concentration urinaire de chrome de l’ordre de 40 µg/l correspond à une exposition moyenne de 0,1 mg/m3 de trioxyde de chrome.
Le chrome hexavalent traverse facilement les membranes cellulaires et, une fois à l’intérieur de la cellule, il est réduit en chrome trivalent. La concentration érythrocytaire de chrome pourrait être un indicateur de l’intensité de l’exposition au chrome hexavalent pendant la durée de vie des hématies, mais cette règle ne s’applique pas au chrome trivalent.
L’intérêt de la surveillance des concentrations urinaires de chrome dans l’estimation des risques pour la santé reste à établir.
Une fois absorbé par inhalation et, dans une moindre mesure, par voie orale, le cobalt — qui a une demi-vie biologique de quelques jours — s’élimine principalement par voie urinaire. L’exposition aux composés solubles de cobalt conduit à une augmentation des concentrations sanguines et urinaires.
Les concentrations de cobalt dans le sang et l’urine dépendent surtout de l’exposition récente. Chez des sujets non exposés professionnellement, le cobalt urinaire est d’ordinaire inférieur à 2 µg/g de créatinine et le cobalt sérique ou plasmatique inférieur à 0,05 µg/100 ml.
Pour des expositions moyennes (pondérées en fonction du temps) de 0,1 mg/m3 et 0,05 mg/m3, on a constaté sur des échantillons recueillis en fin de poste des concentrations urinaires moyennes de 30 à 75 µg/l et de 30 à 40 µg/l, respectivement. Le moment des prélèvements est important, car on observe une augmentation progressive des concentrations urinaires de cobalt au cours de la semaine de travail.
Chez les travailleurs exposés à des oxydes ou des sels de cobalt, ou à du cobalt en poudre dans une raffinerie, on a constaté qu’une exposition moyenne, pondérée en fonction du temps, de 0,05 mg/m3 conduisait à une concentration moyenne de cobalt de 33 et 46 µg/g de créatinine dans les urines recueillies respectivement le lundi et le vendredi en fin de poste.
Le plomb inorganique, toxique cumulatif absorbé par les poumons et le tube digestif, est le métal qui a été le mieux étudié. Il en résulte que la fiabilité des méthodes biologiques utilisées pour évaluer aussi bien l’exposition récente que la charge corporelle est meilleure pour le plomb que pour tous les autres contaminants métalliques.
En cas d’exposition constante, la concentration de plomb dans le sang total est considérée comme le meilleur indicateur de la concentration dans les tissus mous et, donc, de l’exposition récente. L’augmentation de la concentration sanguine s’atténue cependant progressivement lorsque le degré d’exposition s’élève. Après une exposition professionnelle prolongée, la concentration sanguine de plomb ne retombe pas nécessairement à la valeur initiale quand l’exposition cesse, en raison d’une libération continue de plomb à partir des dépôts tissulaires. Les concentrations sanguines et urinaires normales de plomb sont généralement inférieures à 20 µg/100 ml et 50 µg/g de créatinine, respectivement. Ces concentrations peuvent dépendre des habitudes alimentaires et du lieu de résidence des sujets concernés. L’Organisation mondiale de la santé (OMS) a proposé une valeur maximale admissible pour la plombémie de 40 µg/100 ml chez les hommes adultes et de 30 µg/100 ml chez les femmes en âge de procréer. Chez les enfants, des réactions indésirables au niveau du système nerveux central ont été corrélées à des valeurs inférieures à ces limites. La concentration urinaire de plomb s’élève de façon exponentielle avec le taux sanguin et, à l’état d’équilibre, elle traduit surtout l’exposition récente.
La quantité de plomb excrétée dans l’urine après administration d’un agent chélateur (EDTA calcique, par exemple) est le reflet de la réserve de plomb mobilisable. Chez des sujets témoins, la quantité de plomb excrétée dans l’urine, dans les 24 heures suivant l’administration intraveineuse de 1 g d’EDTA, n’excède généralement pas 600 µg. Il semble que, lors d’une exposition constante, les quantités de plomb chélatables correspondent principalement aux réserves de plomb présentes dans les tissus mous et dans le sang, une petite fraction seulement provenant du tissu osseux.
Une technique à fluorescence X a été mise au point pour mesurer les concentrations de plomb dans les tissus osseux (phalanges, tibia, calcanéum, vertèbres), mais la limite de détection de cette technique en restreint actuellement l’utilisation aux sujets professionnellement exposés.
La technique du dosage du plomb dans les cheveux a été proposée pour évaluer la réserve de plomb mobilisable. Sur un lieu de travail, il est cependant difficile de distinguer le plomb endogène incorporé dans les cheveux de celui qui est simplement adsorbé à leur surface.
Le mesurage de la concentration de plomb dans la dentine péripulpaire des dents de lait a été employé pour estimer l’exposition au plomb au cours de la petite enfance.
Les paramètres reflétant l’interférence du plomb avec des processus biologiques peuvent également être utilisés pour évaluer l’intensité d’une exposition saturnine. Les paramètres biologiques couramment utilisés sont la coproporphyrine urinaire (COPRO-U), l’acide delta-aminolévulinique urinaire (ALA-U), la protoporphyrine érythrocytaire (PE, ou protoporphyrine zinc, PPZ), ainsi que l’acide delta-aminolévuliniquedéshydratase (ALAD) et la 5’-pyrimidine nucléotidase (5PN) érythrocytaires. A l’état d’équilibre, les modifications de ces paramètres sont en corrélation positive (COPRO-U, ALA-U, PE) ou négative (ALAD, 5PN) avec celles de la plombémie. L’excrétion urinaire de la COPRO (surtout l’isomère III) et de l’ALA commence à augmenter lorsque la plombémie est voisine de 40 µg/100 ml. La protoporphyrine érythrocytaire commence à s’accroître significativement pour des plombémies d’environ 35 µg/100 ml chez l’homme et 25 µg/100 ml chez la femme. A l’arrêt d’une exposition saturnine professionnelle, le taux de protoporphyrine érythrocytaire reste élevé. Ce taux n’est pas en corrélation avec la plombémie, mais il est par contre corrélé à la quantité de plomb chélatable excrétée dans les urines.
Une légère carence en fer peut également provoquer une augmentation de la protoporphyrine érythrocytaire. Les enzymes érythrocytaires (ALAD et 5PN) sont très sensibles à l’action inhi- bitrice du plomb. Pour des concentrations sanguines de plomb allant de 10 à 40 µg/100 ml, on observe une forte corrélation négative entre l’activité de ces deux enzymes et la plombémie.
Dans certains pays, le tétraéthylplomb et le tétraméthylplomb sont utilisés comme agents antidétonants dans les carburants automobiles. La plombémie n’est pas un bon indicateur de l’exposition au tétraalkylplomb, alors que le plomb urinaire semble être un bon indicateur du risque de surexposition.
En milieu professionnel, le manganèse pénètre dans l’organisme surtout par voie pulmonaire; l’absorption par le tractus gastro-intestinal (qui est par ailleurs faible) semble dépendre d’un mécanisme homéostasique. L’élimination du manganèse se fait par la bile, de petites quantités seulement étant excrétées dans les urines.
Les concentrations normales de manganèse dans l’urine, le sang, le plasma/sérum sont habituellement inférieures à 3 µg/g de créatinine, 1 µg/100 ml et 0,1 µg/100 ml, respectivement.
Il semble que, à l’échelle individuelle, ni le taux sanguin, ni le taux urinaire de manganèse ne soient corrélés aux paramètres d’exposition externe.
Il n’existe apparemment pas de relation directe entre les concentrations de manganèse dans les milieux biologiques et la sévérité des intoxications chroniques par ce métal. Il est possible qu’après une exposition professionnelle, des effets nocifs précoces soient décelables au niveau du système nerveux central pour des concentrations proches des valeurs normales.
L’inhalation représente la principale voie de pénétration du mercure métallique, l’absorption gastro-intestinale étant quant à elle négligeable. Les sels minéraux de mercure sont absorbés aussi bien par les poumons (inhalation d’un aérosol de mercure inorganique) que par le tube digestif. L’absorption cutanée du mercure métallique et de ses sels minéraux est possible.
La demi-vie biologique du mercure est de l’ordre de deux mois dans les reins, mais elle est beaucoup plus longue dans le système nerveux central.
Le mercure inorganique est principalement excrété par les fèces et les urines. De petites quantités sont excrétées dans la salive, les larmes et la sueur. Le mercure peut également être mis en évidence dans l’air expiré, au cours des quelques heures faisant suite à une exposition à des vapeurs de mercure. Dans des conditions d’exposition chronique, il existe une relation entre l’intensité de l’exposition récente à des vapeurs de mercure et les concentrations sanguines ou urinaires, du moins à l’échelle collective. Lors des premières études dans lesquelles des échantillons statiques ont été utilisés pour surveiller l’air ambiant d’un atelier, il est apparu qu’une concentration moyenne de mercure dans l’air (Hg-air) de 100 µg/m3 correspondait à des concentrations moyennes de mercure sanguin (Hg-S) et urinaire (Hg-U) de 6 µg Hg/100 ml et 200 à 260 µg/l, respectivement. Des observations plus récentes destinées à évaluer le rôle du micro-environnement entourant les voies respiratoires des personnes permettent d’établir la relation 1:1,2:0,045 entre le mercure dans l’air (µg/m3), le mercure urinaire (µg/g de créatinine) et le mercure sanguin (µg/100 ml). Plusieurs études épidémiologiques menées chez des travailleurs exposés à des vapeurs de mercure ont montré que, lors d’une exposition de longue durée, les concentrations induisant un effet critique sont d’environ 50 µg/g de créatinine pour le Hg-U et 2 µg/100 ml pour le Hg-S.
Des études récentes semblent cependant indiquer que des signes d’effets nocifs sur le système nerveux central ou le rein peuvent être observés à des concentrations urinaires de mercure inférieures à 50 µg/g de créatinine.
Les concentrations normales dans l’urine et le sang sont généralement inférieures à 5 µg/g de créatinine et 1 µg/100 ml, respectivement. Ces valeurs peuvent varier en fonction de la consom- mation de poisson ou du nombre d’amalgames dentaires au mercure que compte le sujet.
Les organo-mercuriels sont aisément absorbés par toutes les voies. Dans le sang, ils se retrouvent principalement dans les hématies (environ 90%). Il s’impose de faire une distinction entre les composés à courte chaîne alkyle (principalement le méthylmercure), très stables et résistants à toute biotransformation, et les composés arylmercuriels et alkoxymercuriels, qui libèrent du mercure inorganique in vivo. Pour ces derniers, la concentration du mercure sanguin ou urinaire est vraisemblablement un bon indicateur de l’intensité de l’exposition.
A l’état d’équilibre, le mercure dans le sang total ou les cheveux est corrélé à la charge corporelle en méthylmercure et au risque d’intoxication par ce composé. Chez les sujets exposés pendant de nombreuses années à des composés alkylmercuriels, les premiers signes d’intoxication (paresthésie, troubles de la sensibilité) peuvent survenir lorsque les concentrations de mercure dans le sang ou les cheveux dépassent respectivement 20 µg/100 ml et 50 µg/g.
Le nickel n’est pas un toxique cumulatif et la quasi-totalité de la quantité absorbée est excrétée principalement dans l’urine, avec une demi-vie biologique de 17 à 39 heures. Chez les sujets qui n’y sont pas exposés de par leur travail, les concentrations urinaires et plasmatiques de nickel sont d’ordinaire inférieures à 2 µg/g de créatinine et 0,05 µg/100ml, respectivement.
Les concentrations de nickel dans le plasma et dans l’urine constituent de bons indicateurs de l’exposition récente au nickel métallique et à ses composés solubles (par exemple, lors du nickelage électrolytique ou de la fabrication de batteries au nickel). Des valeurs se situant dans les limites de la normale témoignent habituellement d’une exposition non significative, alors que des valeurs supérieures sont le signe d’une surexposition.
Dans le cas des personnes exposées professionnellement à des composés solubles du nickel, la limite biologique de 30 µg/g de créatinine (à la fin du poste) a été proposée provisoirement pour le nickel urinaire.
Chez les sujets au contact de composés du nickel peu solubles ou insolubles, des concentrations accrues dans les liquides biologiques objectivent généralement une absorption significative ou une libération progressive des quantités stockées par les poumons; des quantités notables de nickel peuvent cependant se déposer dans les voies respiratoires (cavités nasales, poumons) sans élévation significative des concentrations plasmatiques ou urinaires. Les valeurs «normales» doivent donc être interprétées avec prudence, car elles ne sont pas nécessairement synonymes d’absence de risque pour la santé.
Le sélénium est un oligo-élément essentiel. Les composés solubles du sélénium semblent être facilement absorbés par les poumons et le tractus gastro-intestinal. Le sélénium est surtout excrété dans les urines mais, lorsque l’exposition est très forte, il peut aussi être excrété dans l’air expiré sous forme de vapeur de séléniure de diméthyle. Les concentrations normales dans le sérum et les urines dépendent de l’absorption journalière, qui peut varier sensiblement selon les régions, mais elles sont d’ordinaire inférieures à 15 µg/100ml et 25 µg/g de créatinine, respectivement. Le sélénium urinaire traduit l’exposition récente. La relation entre l’intensité de l’exposition et la concentration urinaire de sélénium n’a pas encore été établie.
Il semble que les concentrations plasmatiques (ou sériques) et urinaires reflètent surtout l’exposition de courte durée, le sélénium érythrocytaire témoignant plutôt de l’exposition de longue durée.
Les dosages sanguins ou urinaires de sélénium permettent d’établir un bilan, plus souvent pratiqué pour rechercher un déficit qu’une surexposition. Il n’est guère possible de proposer actuellement une limite biologique, car on ne dispose pas de données suffisantes sur les risques d’une exposition de longue durée au sélénium et sur la relation entre les risques potentiels pour la santé et les concentrations dans les milieux biologiques.
Dans l’industrie, le vanadium est absorbé principalement par voie pulmonaire, l’absorption orale semblant faible (moins de 1%). Le vanadium est excrété par les urines avec une demi-vie biologique d’environ 20 à 40 heures et, pour une faible part, dans les fèces. Le vanadium urinaire semble être un bon indicateur de l’exposition récente, mais la relation entre la quantité retenue dans l’organisme et les concentrations urinaires n’a pas encore été bien établie. Il a été mentionné que l’écart entre les concentrations urinaires de vanadium constatées avant et après le poste de travail pourrait permettre d’évaluer l’exposition pendant cet intervalle de temps, alors que le dosage urinaire pratiqué après deux jours sans exposition (le lundi matin) refléterait l’accumulation du métal dans l’organisme. Chez les personnes non exposées professionnellement, la concentration urinaire de vanadium est d’ordinaire inférieure à 1 µg/g de créatinine. La limite biologique pour le vanadium urinaire a provisoirement été fixée à 50 µg/g de créatinine (en fin de poste).
Les solvants organiques sont volatils et généralement solubles dans les graisses de l’organisme (lipophiles), bien que certains d’entre eux comme le méthanol ou l’acétone soient également solubles dans l’eau (hydrophiles). Ils ont été largement employés dans l’industrie et pour la fabrication de produits d’utilisation courante tels que les peintures, les encres, les diluants, les dégraissants, les produits de nettoyage à sec, les détachants ou les répulsifs. Bien que la surveillance biologique puisse servir à mettre en évidence leurs effets préjudiciables sur la santé (au niveau du foie ou des reins, par exemple), il est de loin préférable de surveiller le niveau d’exposition chez les personnes qui travaillent au contact des solvants organiques. Cette méthode, suffisamment sensible, permet en effet de donner l’alerte bien avant la survenue de phénomènes de toxicité. La détection des personnes particulièrement sensibles à la toxicité des solvants peut aussi contribuer à protéger la santé des travailleurs.
Dans les conditions habituelles d’emploi, les solvants organiques sont volatils, bien que ce paramètre varie d’un solvant à l’autre. Le principal mode d’exposition en milieu de travail est donc l’inhalation. Le taux d’absorption est beaucoup plus important au niveau des alvéoles pulmonaires qu’à celui de l’appareil digestif, des taux d’absorption pulmonaire de l’ordre de 50% étant considérés comme caractéristiques des solvants courants tels que le toluène. A l’état liquide, certains solvants comme le sulfure de carbone et le N,N-diméthylformamide (DMF) peuvent traverser la peau intacte en quantités suffisamment importantes pour entraîner des effets toxiques.
Après absorption d’un solvant, une partie est exhalée par la respiration sans aucune biotransformation, alors que la majeure partie est distribuée dans les organes et les tissus riches en lipides, en raison du caractère lipophile de ce type de produit. La biotransformation se déroule principalement dans le foie (et, dans une moindre mesure, dans d’autres organes); par un processus d’oxydation, puis de conjugaison, la molécule devient suffisamment hydrophile pour être excrétée par voie urinaire sous forme de métabolite(s). Une faible partie peut aussi être éliminée sous forme inchangée dans les urines.
D’un point de vue pratique, on peut donc faire appel à trois milieux biologiques pour surveiller l’exposition aux solvants: l’urine, le sang et l’air expiré. Lorsqu’on choisit l’un ou l’autre de ces milieux, il faut tenir compte d’un paramètre important, à savoir la vitesse de disparition de la substance absorbée. Ce paramètre, que l’on peut évaluer quantitativement par la demi-vie biologique, correspond au temps nécessaire pour que la concentration diminue de moitié dans le milieu en question. C’est ainsi que les solvants disparaissent de l’air expiré beaucoup plus rapidement que leurs métabolites urinaires en raison d’une demi-vie beaucoup plus courte. La demi-vie biologique de ces métabolites varie par ailleurs en fonction de la rapidité du métabolisme du solvant absorbé, de sorte que le moment du prélèvement par rapport à l’exposition est essentiel (voir ci-après). Un deuxième paramètre important dans le choix du milieu biologique est la spécificité du produit chimique recherché par rapport à l’exposition. Ainsi, l’acide hippurique, utilisé depuis longtemps comme marqueur de l’exposition au toluène, n’est pas seulement formé dans l’organisme, mais peut aussi avoir une origine autre que professionnelle (additifs alimentaires, par exemple). Il n’est donc plus considéré comme un marqueur fiable en cas de faibles expositions au toluène (inférieures à 50 cm3/m3). D’une manière générale, les métabolites urinaires sont très largement utilisés comme indicateurs d’exposition à différents solvants organiques. La recherche d’un solvant dans le sang donne des informations qualitatives sur l’exposition, car le composé disparaît généralement plus vite de ce milieu et ce résultat reflète surtout les situations d’exposition aiguë. Le dosage du solvant dans l’air expiré est difficile à utiliser pour évaluer l’intensité moyenne de l’exposition, la concentration dans l’air alvéolaire diminuant rapidement lorsque le sujet cesse d’être exposé. Le dosage urinaire des solvants constitue en revanche une solution prometteuse pour évaluer l’exposition, mais des études de validation complémentaires s’imposent.
Comme nous l’avons mentionné, le moment du prélèvement est un paramètre essentiel de la surveillance biologique en cas d’exposition à des solvants. Le tableau 27.2 indique les moments recommandés pour les expositions professionnelles quotidiennes aux solvants les plus courants. Lorsque l’analyse concerne le solvant lui-même, il faut prendre soin d’éviter toute perte, par évaporation, par exemple, ou toute contamination, notamment par l’air ambiant lors de la manipulation des échantillons prélevés. Des précautions identiques devraient être prises lorsque les prélèvements sont transportés vers un laboratoire extérieur ou sont conservés avant l’analyse. La congélation est recommandée pour les métabolites, alors que la réfrigération (mais non la congélation) est préférable pour le solvant lui-même qui devrait être placé dans un récipient étanche et sous vide (de préférence dans un flacon à «espace de tête»). Dans une analyse chimique, le contrôle qualité est indispensable à la fiabilité des résultats (voir l’article intitulé «L’assurance qualité» dans le présent chapitre) et des règles d’éthique devraient être respectées pour la communication des résultats (voir chapitre no 19, «Les questions d’éthique»).
|
Solvants |
Produits chimiques recherchés |
Urine/sang |
Moment de prélèvement1 |
|
N,N-diméthyl-formamide |
N-méthylformamide |
Urine |
L Ma Me J V |
|
2-Ethoxyéthanol et son acétate |
Acide éthoxyacétique |
Urine |
J V (fin du dernier poste) |
|
Hexane |
2,4-Hexanedione |
Urine |
L Ma Me J V |
|
Méthanol |
Méthanol |
Urine |
L Ma Me J V |
|
Styrène |
Acide mandélique |
Urine |
J V |
|
Sulfure de carbone |
Acide 2-thiothiazolidine-4-carboxylique |
Urine |
J V |
|
Toluène |
Acide hippurique |
Urine |
Ma Me J V |
|
Trichloroéthylène |
Acide trichloroacétique |
Urine |
J V |
|
Xylènes2 |
Acides méthylhippuriques |
Urine |
Ma Me J V |
1 Fin de poste, sauf indication contraire (jours indiqués = jours de prélèvement préférés).
2 Trois isomères, séparés ou combinés.
Source: d'après OMS, 1996.
Il existe des procédures analytiques pour le dosage de nombreux solvants. Ces méthodes varient selon le produit chimique considéré, mais la plupart de celles qui ont été mises au point récemment font appel à la chromatographie en phase gazeuse (CG) ou à la chromatographie liquide à haute performance (CLHP). L’utilisation d’un échantillonneur automatique et le traitement informatique des données sont recommandés pour assurer le contrôle qualité des résultats. Lorsqu’on doit analyser un solvant sous forme inchangée dans le sang ou dans l’urine, il est très utile de recourir à la technique de la chromatographie en phase gazeuse avec «espace de tête», surtout pour les solvants qui sont relativement volatils. Le tableau 27.3 donne quelques exemples de méthodes utilisées pour les solvants les plus courants.
|
Solvants |
Produits chimiques recherchés |
Urine/sang |
Techniques analytiques |
|
N,N-diméthyl-formamide |
N-méthylformamide |
Urine |
Chromatographie en phase gazeuse avec détection thermo-ionique (CG-DTI) |
|
2-Ethoxyéthanol et son acétate |
Acide éthoxyacétique |
Urine |
Extraction, dérivation et chromatographie en phase gazeuse avec détection à ionisation de flamme (CG-FID) |
|
Hexane |
2,4-Hexanedione |
Urine |
Extraction, (hydrolyse) et CG-FID |
|
Méthanol |
Méthanol |
Urine |
CG- FID avec espace de tête |
|
Styrène |
Acide mandélique |
Urine |
Filtration et CLHP-UV |
|
Sulfure de carbone |
Acide 2-thiothiazolidine-4-carboxylique |
Urine |
Chromatographie liquide haute performance avec détection ultraviolette (CLHP-UV) |
|
Toluène |
Acide hippurique |
Urine |
Filtration et CLHP-UV |
|
Trichloro-éthylène |
Acide trichloroacétique |
Urine |
Colorimétrie ou estérification et chromatographie en phase gazeuse avec détection à capture d’électrons (CG-DCE) |
|
Xylènes |
Acides méthylhippuriques (trois isomères, séparés ou combinés) |
Urine |
CG-FID avec espace de tête |
Source: d'après OMS, 1996.
Une relation linéaire entre les indicateurs d’exposition (cités dans le tableau 27.3) et l’intensité de l’exposition peut être établie à l’aide d’une enquête auprès de personnes exposées professionnellement ou par exposition expérimentale de volontaires humains. C’est ainsi qu’en 1994, la Conférence américaine des hygiénistes gouvernementaux du travail (American Association of Governmental Industrial Hygienists (ACGIH)) et la Commission de recherche allemande (Deutsche Forschungsgemeinschaft (DFG)) ont défini respectivement l’indice biologique d’exposition (BEI) et la limite de tolérance biologique (BAT) qui sont aux échantillons biologiques ce que la valeur limite d’exposition professionnelle (TLV) et la concentration maximale admissible (MAK) sont aux prélèvements d’ambiance. On sait cependant que la concentration d’un produit chimique dans les échantillons provenant d’individus non exposés peut varier en fonction des habitudes locales, par exemple l’alimentation, et que les différences ethniques peuvent elles aussi avoir une incidence sur le métabolisme des solvants. Il est donc souhaitable d’établir les valeurs limites après avoir étudié la population locale concernée.
Lors de l’évaluation des résultats, il faut prendre soin d’exclure toute exposition non professionnelle à des solvants (utilisation de produits contenant des solvants ou inhalation intentionnelle), de même que l’exposition à des produits chimiques, comme les additifs alimentaires, donnant naissance à des métabolites identiques. La possibilité d’une absorption cutanée devrait être envisagée lorsqu’on observe une discordance importante entre l’intensité de l’exposition à des vapeurs de solvants et les résultats de la surveillance biologique. Le tabagisme inhibe le métabolisme de certains solvants (toluène, par exemple), tandis que la consommation excessive d’alcool (éthanol) peut inhiber le métabolisme du méthanol par un mécanisme compétitif.
La surveillance biologique utilise des échantillons de liquides biologiques ou d’autres milieux biologiques faciles à prélever soit pour évaluer l’exposition à des substances spécifiques ou non spécifiques ou à leurs métabolites, soit pour évaluer les effets biologiques d’une telle exposition. La surveillance biologique permet de mesurer l’exposition totale subie par un individu par les différentes voies (poumons, peau, tractus gastro-intestinal) et sources d’exposition (air, alimentation, mode de vie ou profession). On sait qu’il n’est pas rare en milieu de travail que les travailleurs soient exposés à plusieurs produits ou facteurs de risque qui interagissent et majorent ou inhibent les effets de chaque produit considéré individuellement. Etant donné les différences interindividuelles de constitution génétique, les réponses à une exposition chimique varient d’un sujet à l’autre. Il est donc plus réaliste de rechercher directement les effets précoces chez les individus ou les groupes exposés que d’essayer de prévoir les risques potentiels des situations d’expositions complexes à partir de données se rapportant aux différents produits considérés isolément. C’est précisément la démarche adoptée pour la surveillance génétique des effets précoces, qui a recours à des techniques visant à rechercher les lésions cytogénétiques, les mutations ponctuelles ou les adduits à l’ADN dans des tissus humains représentatifs (voir l’article «Les principes généraux» du présent chapitre).
La génotoxicité d’un produit chimique est une caractéristique chimique intrinsèque dérivée du potentiel électrophile du produit, c’est-à-dire de son aptitude à se lier, dans les macromolécules cellulaires, à des sites nucléophiles tels que l’acide désoxyribonucléique (ADN), porteur de l’information génétique. La génotoxicité est donc une toxicité qui s’exerce sur le matériel génétique des cellules.
La définition de la génotoxicité, telle qu’établie dans un rapport de consensus du Centre international de recherche sur le cancer (CIRC, 1992), est large et inclut à la fois des effets directs et indirects sur l’ADN: 1) induction de mutations (géniques, chromosomiques, génomiques, par recombinaison) qui, à l’échelle moléculaire, sont des événements semblables à ceux qui participent à la cancérogenèse; 2) événements indirectement associés à la mutagenèse (synthèse non programmée de l’ADN ou échange de chromatides sœurs); 3) lésions de l’ADN (formation d’adduits) pouvant conduire à des mutations.
Les mutations sont des modifications héréditaires permanentes des lignées cellulaires, touchant soit les cellules somatiques, soit les cellules germinales (cellules sexuelles). Elles peuvent donc affecter l’organisme par modification des cellules somatiques ou être transmises à la descendance en raison des lésions induites au niveau des cellules sexuelles. La génotoxicité précède ainsi la mutagénicité, mais il faut rappeler que la plupart des lésions génotoxiques sont réparées et ne sont jamais exprimées sous forme de mutations. Les mutations somatiques sont induites au niveau cellulaire et, dans le cas où elles conduisent à la mort cellulaire ou à des atteintes malignes, elles peuvent se manifester par des troubles variés au niveau des tissus ou de l’organisme lui-même. Le vieillissement ou la formation de plaques d’athérosclérose sont vraisemblablement des effets liés à des mutations somatiques (voir figure 27.3 et le chapitre no 2 «Le cancer»).
Les mutations de la lignée cellulaire germinale peuvent être transférées au zygote (l’œuf fécondé) pour s’exprimer à la génération suivante (voir également le chapitre no 9 «Le système reproducteur»). Les troubles mutationnels les plus importants retrouvés chez le nouveau-né sont dus à une mauvaise séparation des chromosomes pendant la gamétogenèse (développement des cellules germinales), conduisant à des syndromes chromosomiques graves (par exemple, trisomie 21 ou syndrome de Down, et monosomie X ou syndrome de Turner).
La figure 27.3 représente de manière schématique le processus génotoxique, depuis l’exposition jusqu’aux effets prévisibles.
Différents arguments expérimentaux indirects permettent de con- firmer la relation entre génotoxicité et cancérogénicité, comme le montre la figure 27.4.
C’est cette corrélation qui sert de fondement à l’utilisation des marqueurs biologiques de génotoxicité comme indicateurs du risque de cancer chez l’humain.
Le rôle des altérations génétiques en cancérogenèse explique l’importance des tests de toxicité génétique aux fins de l’identification des agents cancérogènes potentiels. Différents tests à court terme permettent de détecter des signes de génotoxicité ayant un rapport probable avec le processus de cancérogenèse.
Plusieurs études à grande échelle ont été réalisées afin de comparer le pouvoir cancérogène de certains produits chimiques et les résultats obtenus lors de tests à court terme. Il est apparu qu’aucun test validé ne peut fournir à lui seul des informations suffisantes sur l’ensemble des risques génétiques mentionnés ci-dessus, et que tout produit chimique doit être soumis à plusieurs tests. La validité des tests de génotoxicité à court terme utilisés pour prévoir le potentiel cancérogène d’un produit chimique a fait l’objet de nombreuses discussions et synthèses. A partir de ces données, un groupe de travail du CIRC a conclu que la plupart des agents cancérogènes chez l’humain donnent des résultats positifs dans les tests à court terme courants, tels que le test sur Salmonella ou les tests d’aberrations chromosomiques (voir tableau 27.4). Il faut néanmoins souligner que les agents cancérogènes épigénétiques, qui peuvent majorer les processus génotoxiques sans pour autant être eux-mêmes génotoxiques (par exemple, composés à activité hormonale), ne sont pas détectés par les tests à court terme qui montrent uniquement l’activité génotoxique intrinsèque d’une substance.
|
Classification des agents cancérogènes |
Rapport génotoxicité/ cancérogénicité |
% |
|
1: cancérogènes humains avérés |
24/30 |
80 |
|
2A: cancérogènes humains probables |
14/20 |
70 |
|
2B: cancérogènes humains potentiels |
72/128 |
56 |
|
3: non classés |
19/66 |
29 |
Sources: CIRC, 1987, 1989.
La surveillance génétique applique les méthodes de toxicologie génétique à la surveillance biologique des effets génétiques ou à l’évaluation de l’exposition génotoxique de groupes d’individus exposés du fait de leur activité professionnelle, de leur environnement ou de leur mode de vie. La surveillance génétique peut ainsi identifier précocement les expositions génotoxiques auxquelles des groupes d’individus sont soumis, ce qui permet de mettre en évidence les populations à haut risque et de définir les priorités d’intervention. L’utilisation de marqueurs biologiques prédictifs dans une population exposée permet dans tous les cas de gagner du temps (par rapport aux techniques épidémiologiques) et d’intervenir avant que n’apparaissent des effets nocifs, comme une pathologie cancéreuse (voir figure 27.5).
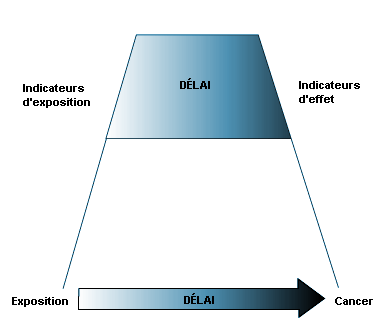
Les méthodes employées actuellement pour la surveillance biologique des expositions génotoxiques et des effets biologiques précoces sont présentées dans le tableau 27.5. Les échantillons utilisés à cette fin doivent répondre à plusieurs critères, notamment être faciles à obtenir et être représentatifs du tissu cible.
|
Marqueurs de surveillance génétique |
Echantillons cellulaires/tissulaires |
|
Aberrations chromosomiques |
Lymphocytes |
|
Echanges entre chromatides sœurs |
Lymphocytes |
|
Micronoyaux |
Lymphocytes |
|
Mutations ponctuelles (gène HPRT, par exemple) |
Lymphocytes et autres tissus |
|
Adduits à l’ADN |
ADN isolé de cellules/tissus |
|
Adduits protéiniques |
Hémoglobine, albumine |
|
Cassures de brin d’ADN |
ADN isolé de cellules/tissus |
|
Activation d’oncogène |
ADN ou protéines spécifiques isolées |
|
Mutations/oncoprotéines |
Différents tissus et cellules |
|
Réparation d’ADN |
Cellules isolées à partir d’échantillons sanguins |
Les altérations reconnaissables de la molécule d’ADN incluent la formation d’adduits à l’ADN et la réorganisation de la séquence d’ADN. Les lésions par formation d’adduits à l’ADN sont décelées par diverses techniques, comme le postmarquage au 32P ou l’utilisation d’anticorps monoclonaux anti-adduits. La détection des cassures de brin d’ADN se fait traditionnellement à l’aide de techniques d’élution alcaline ou de déroulement. Les mutations peuvent être mises en évidence par le séquençage de l’ADN d’un gène spécifique, comme le gène HPRT.
Plusieurs rapports méthodologiques détaillant les techniques utilisées (voir tableau 27.5) ont été publiés (CCE, 1987; CIRC, 1988, 1992, 1994).
La génotoxicité peut aussi être contrôlée indirectement par la détection des adduits protéiques (sur l’hémoglobine, par exemple) ou par la détermination de l’activité réparatrice de l’ADN. En tant que stratégie de surveillance, les contrôles peuvent être effectués de manière ponctuelle ou continue; dans tous les cas, les résultats obtenus doivent contribuer à l’amélioration de la sécurité des conditions de travail.
Des fondements théoriques et empiriques relient cancer et lésions chromosomiques. Les mutations touchant l’activité ou l’expression de gènes de facteurs de croissance sont des étapes clés de la cancérogenèse. De nombreux types de cancers ont été associés à des aberrations chromosomiques, spécifiques ou non. Dans plusieurs maladies héréditaires qui frappent l’être humain, on a pu établir une corrélation entre l’instabilité chromosomique et une sensibilité accrue au cancer.
La surveillance cytogénétique des personnes exposées à des produits chimiques ou à des rayonnements cancérogènes ou mutagènes permet de mettre en évidence les effets sur le matériel génétique. Mais alors que les aberrations chromosomiques sont étudiées depuis plusieurs dizaines d’années chez les personnes exposées à des rayonnements ionisants dans leur travail, seuls quelques agents cancérogènes ont donné lieu à des résultats clairement étayés dans la sphère des produits chimiques.
Les lésions chromosomiques observables en microscopie sont constituées par des aberrations chromosomiques structurelles dans lesquelles on observe d’importantes modifications morphologiques et par des échanges de chromatides sœurs qui consistent en un échange symétrique de matériel chromosomique entre deux chromatides sœurs. Les micronoyaux proviennent de fragments acentriques de chromosomes ou de chromosomes entiers abandonnés. Ce type d’altérations est illustré à la figure 27.6.
Les lymphocytes humains circulants conviennent bien aux études de surveillance, car ils sont faciles à obtenir et permettent d’intégrer l’exposition sur une période relativement longue. L’exposition à de nombreux produits chimiques mutagènes peut accroître la fréquence des aberrations chromosomiques ou des échanges de chromatides sœurs dans les lymphocytes circulants des sujets exposés. L’intensité des lésions observées est pratiquement corrélée à l’exposition, bien que cette corrélation n’ait été démontrée que pour quelques produits chimiques.
Lorsque les tests cytogénétiques effectués sur des lymphocytes circulants révèlent une atteinte du matériel génétique, les résultats ne peuvent servir à estimer le risque qu’à l’échelle d’une population. Une augmentation de la fréquence des aberrations chromosomiques dans une population devrait être considérée comme le signe d’un risque accru de cancer, mais les tests cytogénétiques ne permettent pas de prévoir le risque de cancer sur une base individuelle.
Les lésions génétiques somatiques observées sur les lymphocytes circulants d’un prélèvement n’ont guère de signification à l’échelle individuelle puisque la plus grande partie des lymphocytes porteurs de lésions génétiques sont détruits et remplacés.
Il faut pouvoir compter sur un plan d’étude rigoureux pour assurer une surveillance biologique chez l’humain, car de nombreux facteurs individuels non liés à l’exposition au(x) produit(s) chimique(s) spécifiquement recherché(s) peuvent affecter les réponses biologiques étudiées. Dans la mesure où les études de surveillance biologique sont longues et difficiles, il est important de bien les planifier. La confirmation expérimentale du potentiel génotoxique d’un produit chimique est une condition préalable de toute étude cytogénétique chez l’être humain.
Deux causes majeures de variations peuvent survenir lors des études de surveillance biologique cytogénétique. La première peut être due à des facteurs techniques liés à une discordance de lecture des lames ou aux conditions de culture, notamment au type de milieu, à la température ou à la concentration des substances chimiques ajoutées au milieu de culture (bromodésoxyuridine ou cytochalasine-B, par exemple). Le moment de l’échan- tillonnage peut également avoir une influence sur les résultats du test d’aberrations chromosomiques et, sans doute également, du test des échanges de chromatides sœurs, en raison de modifications au niveau des sous-populations lymphocytaires T et B. Dans le test des micronoyaux, les résultats obtenus dépendent étroitement de la méthodologie (par exemple, utilisation de cellules binucléées induites par la cytochalasine-B).
Les lésions causées à l’ADN lymphocytaire par l’exposition à des produits chimiques qui conduisent à des aberrations chromosomiques, à des échanges de chromatides sœurs ou à des micronoyaux doivent persister in vivo jusqu’au moment du prélèvement sanguin, puis in vitro jusqu’à ce que les lymphocytes en culture commencent à synthétiser de l’ADN. Il est donc important d’examiner les cellules immédiatement après leur première division (en cas d’aberrations chromosomiques ou de micronoyaux) ou après la seconde division (lors d’échanges de chromatides sœurs) afin d’estimer au mieux les lésions induites.
La lecture des résultats est un aspect capital de la surveillance biologique cytogénétique. Les lames doivent être randomisées et codées, afin d’éviter dans toute la mesure possible les biais liés à l’évaluation. Il est indispensable de se référer à des critères d’évaluation cohérents, d’assurer un contrôle de qualité et, enfin, de normaliser les analyses statistiques et la présentation des résultats. Il existe une deuxième cause importante de variation des résultats liée à des facteurs individuels: âge, sexe, prise de médicaments, infections ou encore sensibilité génétique aux produits présents dans l’environnement.
Il est essentiel de constituer un groupe témoin présentant des caractéristiques aussi proches que possible de celles du groupe étudié, tant pour le sexe et l’âge que pour les habitudes tabagiques, les infections virales et les vaccinations, la consommation d’alcool, la prise de médicaments et l’exposition aux rayons X. L’exposition professionnelle au(x) produit(s) génotoxique(s) suspecté(s) devra également être connue qualitativement (type de travail, ancienneté de l’exposition) et quantitativement (concentration du produit dans la zone respiratoire et métabolites spécifiques, si possible). Une attention particulière devrait être portée à l’analyse statistique des résultats.
A ce jour, ce n’est que pour certains agents qu’il a été possible de démontrer de manière répétée qu’ils induisaient des modifications cytogénétiques chez l’humain, alors que la plupart des substances cancérogènes connues altèrent les chromosomes lymphocytaires.
L’importance des lésions est fonction du niveau d’exposition, comme cela a été notamment montré pour le chlorure de vinyle, le benzène, l’oxyde d’éthylène et les agents anticancéreux alkylants. Bien que les tests cytogénétiques n’aient pas encore une sensibilité et une spécificité suffisantes pour déceler les cas d’exposition à des substances toxiques dans le milieu professionnel, il reste qu’en présence de résultats positifs, des enquêtes d’hygiène du travail ont souvent été effectuées, même si la relation entre les lésions chromosomiques somatiques et les effets préjudiciables pour la santé n’était pas prouvée.
Les informations dont on dispose en matière de surveillance biologique cytogénétique proviennent pour l’essentiel des situations professionnelles à «forte exposition». Très peu de cas ont été confirmés par plusieurs études indépendantes et la plupart d’entre elles reposaient sur la détection des aberrations chromosomiques. Dans la version mise à jour des Monographies du CIRC (vol. 43 à 50) figurent au total 14 cancérogènes professionnels de classe 1, 2A ou 2B pour lesquels des tests cytogénétiques se sont révélés positifs chez l’humain, avec confirmation de la plupart des résultats chez l’animal (voir tableau 27.6). Cette base de données limitée donne à penser que les produits chimiques cancérogènes ont tendance à être clastogènes, et que ce pouvoir clastogène est associé aux cancérogènes humains connus. Tous les cancérogènes n’induisent cependant pas de lésions cytogénétiques chez l’humain ou les animaux in vivo. Les cas où des données animales positives ne sont pas retrouvées chez l’humain peuvent être dus à des différences de niveau d’exposition. Il est aussi possible que les expositions professionnelles complexes et prolongées chez l’humain ne soient pas comparables aux expérimentations animales de courte durée.
|
Tests cytogénétiques1 |
||||||
|
Humain |
Animal |
|||||
|
Produits/exposition |
AC |
SCE |
MN |
AC |
SCE |
MN |
|
GROUPE 1: cancérogènes avérés chez l’humain |
||||||
|
Arsenic et composés arsenicaux |
? |
? |
+ |
+ |
||
|
Amiante |
? |
– |
– |
|||
|
Benzène |
+ |
+ |
+ |
+ |
||
|
Bis(chlorométhyl)éther et chlorométhylméthyl éther (qualité technique) |
(+) |
– |
||||
|
Chlorure de vinyle |
+ |
? |
+ |
+ |
+ |
|
|
Composés hexavalents du chrome |
+ |
+ |
+ |
+ |
+ |
|
|
Composés du nickel |
+ |
– |
? |
|||
|
Cyclophosphamide |
+ |
+ |
+ |
+ |
+ |
|
|
Fumée de tabac |
+ |
+ |
+ |
+ |
||
|
Melphalan |
+ |
+ |
+ |
|||
|
Radon |
+ |
– |
||||
|
GROUPE 2A: cancérogènes probables chez l’humain |
||||||
|
Acrylonitrile |
– |
– |
– |
|||
|
Adriamycine |
+ |
+ |
+ |
+ |
+ |
|
|
Cadmium et composés cadmiques |
– |
(–) |
– |
|||
|
Cisplatine |
+ |
+ |
+ |
|||
|
Dibromure d’éthylène |
– |
– |
– |
+ |
– |
|
|
Epichlorhydrine |
+ |
? |
+ |
– |
||
|
Formaldéhyde |
? |
? |
– |
– |
||
|
Oxyde d’éthylène |
+ |
+ |
+ |
+ |
+ |
+ |
|
GROUPE 2B: cancérogènes potentiels chez l’humain |
||||||
|
Composés du plomb |
? |
? |
? |
– |
? |
|
|
DDT |
? |
+ |
– |
|||
|
Diméthylformamide |
(+) |
– |
– |
|||
|
Herbicides chlorophénoxy (2,4-D et 2,4,5-T) |
– |
– |
+ |
+ |
– |
|
|
Styrène |
+ |
? |
+ |
? |
+ |
+ |
|
2,3,7,8-Tétrachlorodibenzo- p-dioxine |
? |
– |
– |
– |
||
|
Vapeurs de soudage |
+ |
+ |
– |
– |
||
1 AC = aberrations chromosomiques, SCE = échanges de chromatides sœurs, MN = micronoyaux.
(–) = relation négative dans une seule étude – = relation négative
(+) = relation positive dans une seule étude + = relation positive
? = sans conclusion possible zone non renseignée = test non effectué
Source: CIRC, Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 43 à 50.
Les études de génotoxicité effectuées chez les personnes exposées font appel à des tests très divers en dehors des tests chromosomiques, tels que les lésions de l’ADN, l’activité réparatrice de l’ADN ou les adduits à l’ADN et aux protéines. Certains de ces tests peuvent être plus pertinents que d’autres pour la prévision des risques cancérogènes. Les lésions génétiques stables (réarrangements chromosomiques, délétions et mutations ponctuelles, par exemple) sont très significatives, car leur relation avec la cancérogenèse est connue. La signification des adduits à l’ADN dépend de la méthode d’identification de l’agent chimique concerné et de la relation de cause à effet avec l’exposition. Certains des tests utilisés, comme ceux portant sur les échanges de chromatides sœurs (SCE), la synthèse non programmée de l’ADN (UDS), les protéines se fixant à l’ADN monobrin (SSB) ou les cassures de brin d’ADN sont des indicateurs ou des marqueurs génétiques potentiels, mais leur validité n’est pas établie, faute de connaître les mécanismes conduisant à des altérations génétiques. Il est clair que le marqueur génétique le plus pertinent chez l’humain serait l’induction d’une mutation spécifique ayant un rapport direct avec des processus cancéreux chez les rongeurs exposés au produit chimique étudié (voir figure 27.7).
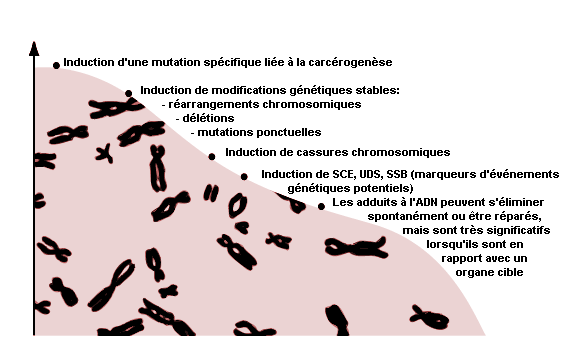
Les progrès rapides des techniques de génétique moléculaire, l’évolution accélérée du séquençage du génome humain et la mise en évidence du rôle des gènes suppresseurs de tumeurs et des proto-oncogènes en cancérogenèse humaine soulèvent des questions de nature éthique quant à l’interprétation, à la communication et à l’utilisation des informations personnelles de ce type. Le développement rapide des techniques d’analyse des gènes humains permettra bientôt d’identifier de nouveaux gènes de sensibilité héréditaires chez les sujets sains asymptomatiques qui se prêteront aux dépistages génétiques (US Office of Technology Assessment, 1990).
De nombreuses questions d’ordre social et éthique se poseront si l’utilisation du dépistage génétique devient une réalité. Dès à présent, une cinquantaine de particularismes génétiques touchant le métabolisme, les polymorphismes enzymatiques, les systèmes de réparation de l’ADN sont soupçonnés d’être à l’origine d’une sensibilité accrue à diverses pathologies, et il existe des tests diagnostiques portant sur l’ADN pour environ 300 maladies génétiques. Plusieurs questions viennent spontanément à l’esprit. Le dépistage génétique est-il de mise en milieu de travail? Qui prendra la décision de faire subir un tel dépistage? Comment seront utilisées ces informations pour les décisions d’embauche ou de carrière? Qui y aura accès et comment les résultats seront-ils communiqués aux personnes concernées? Beaucoup de ces questions sont fortement liées aux normes sociales et aux valeurs éthiques qui ont cours. Le principal objectif doit être la prévention de la maladie et de la souffrance humaine, mais la volonté propre des individus et les principes éthiques ne sauraient pour autant être ignorés. C’est à ces questions d’ordre éthique qu’il faut apporter une réponse avant de mettre en place toute étude de surveillance biologique sur le lieu de travail (voir tableau 27.7 et le chapitre no 19 «Les questions d’éthique»).
|
Destinataires de l’information |
|||
|
Nature de l’information |
Personne concernée |
Médecin du travail |
Employeur |
|
Objet du test |
• |
• |
l |
|
Justification du test |
• |
l |
l |
|
Risques encourus |
• |
l |
l |
|
Données confidentielles |
• |
l |
|
|
Mesures envisagées pour améliorer l’hygiène et réduire l’exposition |
• |
l |
|
La phase de préparation de toute étude de surveillance biologique génétique nécessite du temps et des efforts. Toutes les parties concernées (personnel, employeur, service médical) doivent être clairement informées préalablement à l’étude et être mise au courant des résultats obtenus. Utilisée avec précaution et sous réserve de la fiabilité des résultats, la surveillance biologique génétique peut contribuer à améliorer la sécurité du travail et la santé des travailleurs.
L’exposition humaine aux pesticides présente des caractéristiques différentes selon qu’elle survient lors de leur production industrielle ou de leur mise en œuvre (voir tableau 27.8). La formulation de produits commerciaux (par mélange des principes actifs à d’autres constituants) entraîne cependant des conditions d’exposition comparables en partie à celles que l’on rencontre dans l’agriculture. La fabrication se fait dans de petites entreprises qui fabriquent de nombreux produits par opérations successives au cours desquelles les travailleurs sont exposés pendant un temps limité à toutes sortes de pesticides. Dans les programmes de santé publique comme dans l’agriculture, la règle générale est l’utilisation simultanée de différents produits, sauf pour certaines applications spécifiques où l’on se limite à un seul (par exemple, pour la défoliation du coton ou la prévention du paludisme).
|
Exposition liée à la production |
Exposition liée à l’utilisation |
|
|
Durée d’exposition |
Continue et prolongée |
Variable et intermittente |
|
Niveau d’exposition |
Relativement constante |
Extrêmement variable |
|
Type d’exposition |
Un à plusieurs produits |
Nombreux produits à la suite les uns des autres ou simultanément |
|
Absorption cutanée |
Facile à contrôler |
Variable selon les méthodes de travail |
|
Contrôles d’ambiance |
Utile |
Rarement informative |
|
Surveillance biologique |
Complémentaire des contrôles d’ambiance |
Très utile lorsque disponible |
Source: d’après OMS, 1982b.
Le mesurage des indicateurs biologiques d’exposition aux pesticides est particulièrement intéressant dans le cas des utilisateurs de pesticides pour lesquels les techniques classiques des contrôles d’ambiance sont difficilement applicables. La plupart des pesticides sont des substances liposolubles qui pénètrent dans la peau, d’où l’importance de l’utilisation d’indicateurs biologiques si l’on veut évaluer le niveau d’exposition.
Les indicateurs biologiques d’effet. Les cholinestérases constituent les enzymes cibles responsables de la toxicité des organophosphorés chez les insectes et les mammifères. Il existe deux types principaux de cholinestérases dans l’organisme humain: l’acétylcholinestérase (AChE) et la cholinestérase plasmatique (PChE). Les organophosphorés produisent des effets toxiques chez l’humain par inhibition de l’acétylcholinestérase synaptique au niveau du système nerveux. L’acétylcholinestérase est également présente dans les hématies, où son rôle n’est pas connu. La cholinestérase plasmatique est un terme générique recouvrant un groupe hétérogène d’enzymes présentes dans les cellules gliales, le plasma, le foie et d’autres organes. La PChE est inhibée par les organophosphorés, mais son inhibition ne produit pas de perturbations fonctionnelles connues.
L’inhibition de l’activité de l’AChE et de la PChE dans le sang est fortement corrélée à l’intensité et à la durée d’exposition aux organophosphorés. L’AChE sanguine, qui est aussi la cible moléculaire responsable de la toxicité aiguë de ces insecticides sur le système nerveux, constitue un indicateur beaucoup plus spécifique que la PChE. La sensibilité de l’AChE et de la PChE sanguines à l’effet inhibiteur des organophosphorés varie cependant selon les produits, certains d’entre eux inhibant préférentiellement l’AChE, d’autres surtout la PChE.
Il existe une assez bonne corrélation entre l’activité de l’AChE dans le sang et les signes cliniques de toxicité aiguë (voir tableau 27.9). La corrélation tend à être meilleure lorsque l’inhibition s’accélère; par contre, quand l’inhibition est lente, comme au cours des expositions chroniques à faible concentration, la corrélation avec la maladie devient faible, voire totalement inexistante. L’inhibition de l’AChE dans le sang n’est donc pas un prédicteur des effets chroniques ou différés.
|
Inhibition (%) de l’AChE |
Sévérité de l’intoxication |
Symptômes cliniques |
Pronostic |
|
50-60 |
Légère |
Faiblesse, céphalées, vertiges, nausées, hypersalivation, larmoiement, myosis, spasme bronchique modéré |
Convalescence en 1-3 jours |
|
60-90 |
Modérée |
Faiblesse soudaine, troubles visuels, hypersalivation, hypersudation, vomissements, diarrhée, bradycardie, hypertonie, tremblements (mains et tête), troubles de la démarche, myosis, douleur thoracique, cyanose des muqueuses |
Convalescence en 1-2 semaines |
|
90-100 |
Sévère |
Tremblements soudains, convulsions généralisées, troubles psychiques, cyanose intense, œdème pulmonaire, coma |
Décès par arrêt respiratoire ou cardiaque |
Les valeurs normales de l’activité de l’AChE et de la PChE présentent des variations chez les sujet sains, de même que dans certaines conditions physiopathologiques spécifiques (voir tableau 27.10). La sensibilité de ces paramètres biologiques aux fins du suivi d’une exposition aux organophosphorés est donc meilleure si l’on prend comme référence les valeurs basales de chaque individu avant exposition pour les comparer aux activités cholinestérasiques constatées après exposition. Les valeurs de référence de la population ne devraient être retenues que si les taux individuels avant exposition sont inconnus (voir tableau 27.11).
|
Activité de l’AChE |
Activité de la PChE |
|
|
Sujets sains |
||
|
Variation interindividuelle1 |
10-18% |
15-25% |
|
Variation intra-individuelle1 |
3-7% |
6% |
|
Différence selon le sexe |
Non |
Supérieure de 10 - 15% chez les hommes |
|
Age |
Faible jusqu’à l’âge de 6 mois |
|
|
Masse corporelle |
|
Corrélation positive |
|
Cholestérol sérique |
|
Corrélation positive |
|
Variation saisonnière |
Non |
Non |
|
Variation circadienne |
Non |
Non |
|
Menstruation |
|
Diminuée |
|
Grossesse |
|
Diminuée |
|
Etats pathologiques |
||
|
Activité diminuée |
Leucémie, néoplasie |
Atteinte hépatique, urémie, cancer, insuffisance cardiaque, réactions allergiques |
|
Activité augmentée |
Polyglobulie, thalassémie, autres dyscrasies sanguines congénitales |
Hyperthyroïdie, autres situations de métabolisme accéléré |
1 Source: Augustinsson, 1955; Gage, 1967.
|
Méthode |
Sexe |
AChE* |
PChE* |
|
Michel1 (delta pH/h) |
Hommes |
0,77±0,08 |
0,95±0,19 |
|
Titrimétrie1 (µmol/mn ml) |
Hommes/femmes |
13,2±0,31 |
4,90±0,02 |
|
Ellman modifiée2 (UI/ml) |
Hommes |
4,01±0,65 |
3,03±0,66 |
* Moyenne ± écart-type.
Sources: 1 Laws, 1991. 2 Alcini et coll., 1988.
Le sang devrait être prélevé de préférence dans les 2 heures suivant l’exposition. La ponction veineuse est préférable au prélèvement de sang capillaire recueilli au bout du doigt ou au lobe de l’oreille car, chez les sujets exposés, la peau risque d’être souillée par le pesticide à l’endroit du prélèvement. Il est recommandé de déterminer la valeur normale de base de chaque individu sur trois échantillons successifs prélevés avant exposition (OMS, 1982c).
Il existe diverses méthodes analytiques pour mesurer l’AChE et la PChE sanguines. L’Organisation mondiale de la santé (OMS) recommande comme méthode de référence celle d’Ellman par spectrophotométrie (Ellman et coll., 1961).
Les indicateurs biologiques d’exposition. La surveillance d’une exposition aux organophosphorés est assurée grâce au dosage urinaire des métabolites dérivés de la partie alkylphosphate de la molécule d’organophosphorés ou des résidus d’hydrolyse de la liaison P-X (voir figure 27.8).
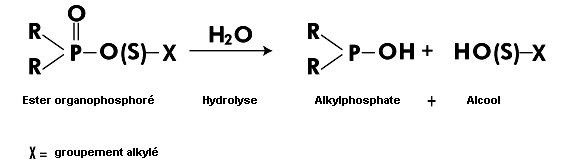
Les métabolites alkylphosphates. Le tableau 27.12 dresse la liste des métabolites urinaires alkylphosphates et des produits dont ils sont issus. Les alkylphosphates urinaires sont des marqueurs sensibles d’exposition aux organophosphorés, leur présence dans l’urine étant en effet décelable pour des niveaux d’exposition auxquels aucune inhibition de la cholinestérase plasmatique ou érythrocytaire n’est observée. L’excrétion urinaire des alkylphosphates a été mesurée dans différentes conditions d’exposition et avec divers organophosphorés (voir tableau 27.13). Quelques études ont établi une relation entre les doses externes de ce type d’insecticide et les concentrations urinaires d’alkylphosphates. Certaines ont démontré une relation significative entre l’activité cholinestérasique et les concentrations urinaires d’alkylphosphates.
|
Métabolites |
Abréviations |
Principaux produits de départ |
|
Monométhylphosphate |
MMP |
Malathion, parathion |
|
Diméthylphosphate |
DMP |
Dichlorvos, trichlorofon, mevinphos, malaoxon, diméthoate, fenchlorphos |
|
Diéthylphosphate |
DEP |
Paraoxon, déméton-oxon, diazinon-oxon, dichlorfenthion |
|
Diméthylthiophosphate |
DMTP |
Fenitrothion, fenchlorphos, malathion, diméthoate |
|
Diéthylthiophosphate |
DETP |
Diazinon, déméthon, parathion, fenchlorphos |
|
Diméthyldithiophosphate |
DMDTP |
Malathion, diméthoate, azinphos-méthyle |
|
Diéthyldithiophosphate |
DEDTP |
Disulfoton, phorate |
|
Acide phénylphosphorique |
|
Leptophos, EPN |
|
Produits |
Conditions d’exposition |
Voies d’exposition |
Concentrations des métabolites1 (mg/l) |
|
Parathion2 |
Intoxication non mortelle |
Orale |
DEP = 0,5 |
|
Disulfoton2 |
Fabrication |
Cutanée/ inhalation |
DEP = 0,01-4,40 |
|
Phorate2 |
Fabrication |
Cutanée/ inhalation |
DEP = 0,02-5,14 |
|
Malathion3 |
Epandage |
Cutanée |
DMDTP = <0,01 |
|
Fenitrothion3 |
Epandage |
Cutanée |
DMP = 0,01-0,42 |
|
Monocrotophos4 |
Epandage |
Cutanée/ inhalation |
DMP = <0,04-6,3/24 h |
1 Pour les abréviations, voir tableau 27.12. 2 Dillon et Ho, 1987. 3 Richter, 1993. 4 van Sittert et Dumas, 1990.
En principe, les alkylphosphates sont excrétés rapidement dans l’urine. Les échantillons urinaires devraient donc être recueillis en fin de poste pour doser ces métabolites.
Le dosage des alkylphosphates urinaires nécessite une méthode analytique assez élaborée, basée sur la dérivation des composés et la détection par chromatographie en phase gazeuse (Shafik et coll., 1973a; Reid et Watts, 1981).
Les résidus d’hydrolyse. Le p-nitrophénol (PNP) est le métabolite phénolique du parathion, du méthylparathion et de l’éthylparathion. Le dosage du PNP urinaire (Cranmer, 1970) est un indicateur fiable qu’on emploie beaucoup pour surveiller les expositions au parathion. Il existe une bonne corrélation entre le PNP urinaire et la quantité de parathion absorbée. Une excrétion urinaire de PNP allant jusqu’à 2 mg/l, après absorption de parathion, ne s’accompagne d’aucun symptôme d’intoxication et d’aucune variation notable des activités cholinestérasiques. Le p-nitrophénol est rapidement excrété et les taux urinaires deviennent insignifiants dans les 48 heures qui suivent l’exposition. Les échantillons urinaires devraient donc être recueillis rapidement après l’exposition.
Les indicateurs biologiques d’effet. Les pesticides carbamiques comprennent des insecticides, des fongicides et des herbicides. La toxicité des carbamates insecticides est due à l’inhibition de l’AChE synaptique, tandis que d’autres mécanismes de toxicité interviennent pour les carbamates herbicides ou fongicides. Seule l’exposition aux insecticides carbamiques est donc justiciable de la recherche de l’activité cholinestérasique érythrocytaire (AChE) ou plasmatique (PChE). L’AChE est habituellement plus sensible à l’effet inhibiteur des carbamates que la PChE. Les personnes exposées professionnellement aux carbamates présentent généralement des symptômes cholinergiques lorsque l’activité de l’AChE dans le sang est inférieure à 70% de la valeur basale individuelle (OMS, 1982b).
L’inhibition des cholinestérases par les carbamates est rapidement réversible. C’est pourquoi des résultats faussement négatifs peuvent être observés si un délai trop long s’écoule entre l’exposition et le recueil de l’échantillon biologique, ou entre celui-ci et l’analyse. Pour éviter ces problèmes, il est recommandé de prélever les échantillons de sang et de les analyser dans les 4 heures qui suivent l’exposition. La préférence devrait être donnée aux méthodes analytiques qui permettent de mesurer l’activité cholinestérasique immédiatement après la prise de sang, comme nous l’avons déjà mentionné pour les organophosphorés.
Les indicateurs biologiques d’exposition. Le dosage des métabolites urinaires comme méthode de surveillance d’une exposition humaine aux carbamates n’a été utilisé que pour quelques produits et dans un nombre limité d’études. Le tableau 27.14 en résume les principales données. Les carbamates étant rapidement excrétés dans l’urine, le dosage des métabolites devrait être effectué sur des échantillons recueillis peu après l’exposition. Les méthodes analytiques pour le dosage de ces métabolites urinaires ont été décrites par Dawson et coll. (1964), DeBernardinis et Wargin (1982) ainsi que Verberk et coll. (1990).
|
Produits |
Indices biologiques |
Conditions d’exposition |
Concentrations dans l’air |
Résultats |
Références |
|
Carbaryl |
alpha-naphthol |
Fabrication |
0,23-0,31 mg/m3 |
x=18,5 mg/l1, taux d’excrétion maximal = 80 mg/j |
OMS, 1982a |
|
Pirimicarbe |
métabolites I2 et V3 |
Epandage |
|
limites = 1-100 µg/l |
Verberk et coll., 1990 |
1 Des intoxications systémiques ont été occasionnellement signalées. 2 2-diméthylamino-4-hydroxy-5,6-diméthylpyrimidine. 3 2-méthylamino-4-hydroxy-5,6-diméthylpyrimidine. x = écart-type.
Les indicateurs biologiques d’exposition. Les dithiocarbamates, qui sont beaucoup employés comme fongicides, appartiennent à trois classes chimiques: thiourames, diméthyldithiocarbamates et éthylène-bis-dithiocarbamates.
Le sulfure de carbone (CS2) et son métabolite principal, l’acide 2-thiothiazolidine-4-carboxylique (TTCA), sont des métabolites communs à la plupart des dithiocarbamates. Une augmentation significative de leur concentration urinaire a été observée dans diverses conditions d’exposition et pour différents pesticides en contenant. L’éthylènethiourée (ETU) est un métabolite urinaire important des éthylène-bis-dithiocarbamates. Ce composé peut également être présent sous forme d’impuretés dans les produits commerciaux. Compte tenu de son potentiel tératogène et cancérogène chez le rat et chez d’autres espèces, et de sa toxicité thyroïdienne, l’ETU est très utilisée pour la surveillance des ex-positions aux éthylène-bis-dithiocarbamates. L’éthylènethiourée n’est pas spécifique d’un produit particulier puisqu’elle peut se former à partir du manèbe, du mancozèbe ou du zinèbe.
Le dosage des métaux présents dans les dithiocarbamates a été proposé comme autre méthode de surveillance des cas d’exposition à ces produits. Une augmentation de l’excrétion urinaire du manganèse a été observée chez les personnes exposées professionnellement au mancozèbe (voir tableau 27.15).
|
Produits |
Indices biologiques |
Conditions d’exposition |
Concentrations dans l’air ambiant* |
Résultats ± écarts-types |
Références |
|
Zirame |
Sulfure de carbone (CS2) |
Fabrication |
1,03 ± 0,62 mg/m3 |
3,80 ± 3,70 µg/l |
Maroni et coll., 1992 |
|
Manèbe/ mancozèbe |
ETU2 |
Epandage |
|
limites = 0,2-11,8 µg/l |
Kurttio et coll., 1990 |
|
Mancozèbe |
Manganèse |
Epandage |
57,2 µg/m3 |
avant exposition: 0,32 ± 0,23 µg/g crιatinine; |
Canossa et coll., 1993 |
* Valeur moyenne selon Maroni et coll., 1992.
1 TTCA = acide 2-thiothiazolidine-4-carboxylique. 2 ETU = éthylènethiourée.
Il est courant de trouver du sulfure de carbone, du TTCA et du manganèse dans l’urine des sujets non exposés. Il est donc recommandé de mesurer les concentrations urinaires de ces composés avant toute exposition et de recueillir les échantillons d’urine le matin suivant l’arrêt de l’exposition. Les méthodes analytiques applicables au dosage du CS2, du TTCA et de l’éthylènethiourée ont été décrites par Maroni et coll. (1992).
Les indicateurs biologiques d’exposition. Les pyréthrinoïdes de synthèse sont des insecticides analogues aux pyréthrines naturelles. Des études réalisées sur des volontaires humains ont permis d’identifier les métabolites urinaires aux fins de la surveillance biologique. L’acide 3-(2,2’-dichloro-vinyl)-diméthyl-cyclopropane carboxylique (Cl2CA), métabolite acide, est excrété chez les sujets traités per os par la perméthrine et la cyperméthrine, l’analogue bromé (Br2CA) étant retrouvé chez les sujets traités par la deltaméthrine. Chez les volontaires traités par la cyperméthrine, un métabolite phénoxy, l’acide 4-hydroxy-phénoxy benzoïque (4-HPBA), a également été identifié. Ces métabolites ne sont cependant pas très employés pour la surveillance des expositions professionnelles en raison de la complexité des techniques analytiques nécessaires (Eadsforth, Bragt et van Sittert, 1988; Kolmodin-Hedman, Swensson et Akerblom, 1982). Chez les utilisateurs de cyperméthrine, les taux urinaires de Cl2CA se situent entre 0,05 et 0,18 mg/l, alors que chez les ouvriers fabriquant l’alpha-cyperméthrine les taux urinaires de 4-HPBA sont inférieurs à 0,02 mg/l.
Il est recommandé de doser les métabolites dans les urines de 24 heures recueillies dès la fin de l’exposition.
Les indicateurs biologiques d’exposition. Les insecticides organochlorés très employés dans les années cinquante et soixante, ont cessé pour la plupart de l’être dans de nombreux pays en raison de leur persistance dans l’environnement.
La surveillance biologique de l’exposition aux organochlorés peut être assurée par le dosage des substances elles-mêmes ou de leurs métabolites dans le sang ou le sérum (Dale, Curley et Cueto, 1966; Barquet, Morgade et Pfaffenberger, 1981). Après absorption, l’aldrine est rapidement métabolisée en dieldrine qui peut être dosée dans le sang. L’endrine a une demi-vie très courte dans le sang et son dosage ne peut donc s’effectuer qu’en cas d’exposition récente. Le dosage d’un métabolite urinaire, l’anti-12-hydroxy-endrine, peut également permettre de surveiller les expositions à l’endrine.
Une corrélation significative entre la concentration des indicateurs biologiques et la survenue d’effets toxiques a été mise en évidence pour certains composés organochlorés. Des signes d’intoxication après exposition à l’aldrine et à la dieldrine apparaissent à des concentrations sanguines de dieldrine supérieures à 200 µg/l. Une concentration sanguine de lindane de 20 µg/l est considérée comme le seuil critique d’apparition de signes et de symptômes neurologiques. Aucun effet nocif aigu n’a été observé chez les travailleurs exposés à des concentrations sanguines d’endrine inférieures à 50 µg/l. Aucun effet indésirable précoce (induction d’enzymes microsomales hépatiques) n’a été signalé pour des expositions répétées à l’endrine entraînant des concentrations urinaires d’anti-12-hydroxy-endrine inférieures à 130 µg/g de créatinine et pour des expositions répétées au DDT correspondant à des concentrations sériques de DDT ou de DDE inférieures à 250 µg/l.
Les organochlorés peuvent être trouvés en faibles concentrations sanguines ou urinaires dans la population générale. Les concentrations mesurées dans le sang peuvent ainsi atteindre 1 µg/l pour le lindane, 10 µg/l pour la dieldrine et 100 µg/l pour le DDT ou le DDE, et les taux urinaires peuvent aller jusqu’à 1 µg/g de créatinine pour l’anti-12-hydroxy-endrine. Il est donc recommandé de mesurer les taux de base initiaux, avant toute exposition.
Chez les sujets exposés, les échantillons sanguins devraient être prélevés dès la fin d’une exposition unique. En cas d’exposition de longue durée, le moment du prélèvement sanguin n’est pas critique. Des échantillons ponctuels d’urine devraient être recueillis en fin d’exposition en vue de doser les métabolites urinaires.
Les indicateurs biologiques d’exposition. Peu de travaux ont porté sur l’excrétion urinaire de l’atrazine et de ses métabolites triaziniques chez les sujets exposés. La figure 27.9 montre les profils d’excrétion urinaire des métabolites de l’atrazine après exposition cutanée à des concentrations d’atrazine de l’ordre de 174 à 275 µmol/poste de travail (Catenacci et coll., 1993). Etant donné que les autres chlorotriazines (simazine, propazine, terbuthylazine) présentent un métabolisme identique à celui de l’atrazine, il est possible de doser les métabolites triaziniques désalkylés pour surveiller l’exposition à tous les herbicides chlorotriaziniques.
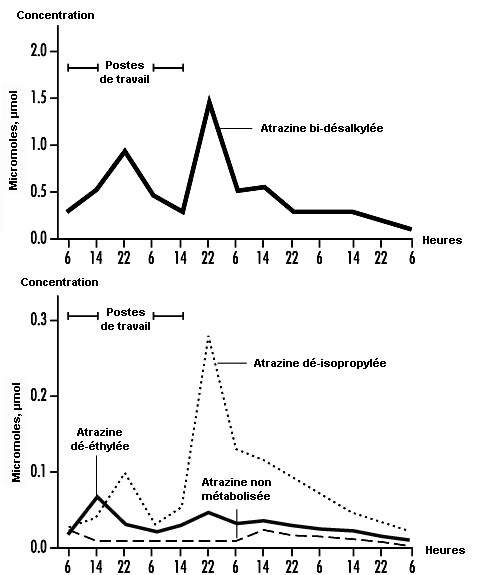
La détermination qualitative des substances inchangées dans l’urine peut être utilisée pour identifier les composés responsables de l’exposition. Il est recommandé de rechercher les métabolites dans les urines de 24 heures recueillies à partir du début de l’exposition.
Un test, appelé test ELISA, a permis d’identifier un conjugué mercapturique de l’atrazine comme métabolite urinaire majeur chez les travailleurs exposés. Ce conjugué est retrouvé à des concentrations au moins dix fois supérieures à celles des métabolites désalkylés. La quantité totale de conjugué mercapturique excrétée sur une période de dix jours est corrélée à l’exposition cutanée et respiratoire cumulée (Lucas et coll. 1993).
Les indicateurs biologiques d’effet. Les rodenticides coumariniques inhibent l’activité des enzymes du cycle de la vitamine K dans le foie des mammifères, y compris chez l’humain (voir figure 27.10), provoquant ainsi une réduction dose-dépendante de la synthèse des facteurs de coagulation dépendant de la vitamine K, particulièrement des facteurs II (prothrombine), VII, IX et X. Les effets anticoagulants apparaissent lorsque les taux plasmatiques des facteurs de coagulation ont diminué d’environ 20% par rapport aux valeurs normales.
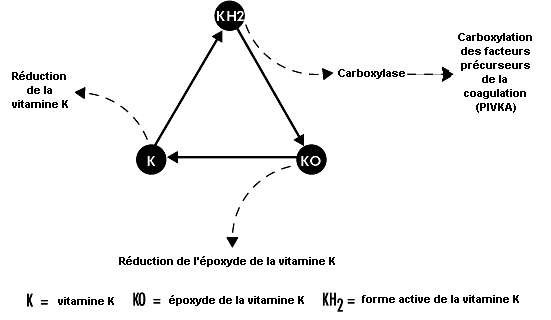
Ces antagonistes de la vitamine K ont été subdivisés en composés de «première génération» (comme la warfarine) et de «seconde génération» (brodifacoum, difenacoum, par exemple), ces derniers étant caractérisés par une très longue demi-vie biologique (100 à 200 jours).
On fait souvent appel au test du temps de Quick (taux de prothrombine) pour surveiller l’exposition aux dérivés coumariniques. Il faut préciser que ce test n’est sensible qu’à partir d’une diminution d’environ 20% des facteurs de coagulation plasmatiques par rapport à la normale. On ne peut donc pas l’employer pour déceler les effets précoces d’une exposition, pour lesquels il est recommandé de mesurer la concentration plasmatique de prothrombine.
A l’avenir, ces tests pourraient être remplacés par la détermination des facteurs précurseurs de la coagulation (PIVKA, ou protéine induite par les antivitamines K), substances retrouvées dans le sang uniquement en cas de blocage du cycle de la vitamine K par les coumarine.
Dans des conditions d’exposition prolongée, le moment des prélèvements sanguins n’est pas critique. En cas de surexposition aiguë, la surveillance biologique devrait être exercée pendant les cinq jours au moins suivant l’exposition, pour tenir compte du délai de latence de l’effet anticoagulant. Il est recommandé de mesurer les valeurs initiales de base avant toute exposition, afin d’augmenter la sensibilité de ces tests.
Les indicateurs biologiques d’exposition. Le dosage sanguin des dérivés coumariniques natifs a été proposé pour surveiller l’exposition chez l’humain. L’application en reste cependant très limitée, car les techniques analytiques sont beaucoup plus complexes (et moins bien normalisées) que celles qui permettent de rechercher les effets sur la coagulation (Chalermchaikit, Felice et Murphy, 1993).
Les indicateurs biologiques d’exposition. Les herbicides phénoxy sont peu métabolisés chez les mammifères. Chez l’humain, plus de 95% de l’acide 2,4-dichlorophénoxyacétique (2,4-D) sont excrétés sous forme inchangée dans l’urine en cinq jours, et les acides 2,4,5-trichlorophénoxyacétique (2,4,5-T) et 4-chloro-2-méthylphénoxyacétique (MCPA) sont également excrétés dans l’urine (essentiellement sous forme inchangée) dans les quelques jours suivant leur absorption par voie orale. Le dosage urinaire des molécules natives est utilisé pour la surveillance des expositions professionnelles à ces herbicides. Dans des études de terrain réalisées chez des travailleurs exposés, on a mis en évidence des taux urinaires compris entre 0,10 et 8 µg/l pour le 2,4-D, entre 0,05 et 4,5 µg/l pour le 2,4,5-T et entre moins de 0,1 µg/l et 15 µg/l pour le MCPA. Pour doser les composés inchangés, il est recommandé de recueillir les urines des 24 heures qui suivent la fin de l’exposition. Draper (1982) a décrit des méthodes analytiques convenant au dosage urinaire des herbicides phénoxy.
Les indicateurs biologiques d’exposition. Le diquat et le paraquat sont des herbicides faiblement biotransformés dans l’organisme humain. En raison de leur forte hydrosolubilité, ils sont facilement excrétés sous forme inchangée dans l’urine. Il n’est pas rare de trouver des concentrations urinaires inférieures à la limite de détection analytique (0,01 µg/l) chez les travailleurs exposés au paraquat; dans les régions tropicales, des concentrations allant jusqu’à 0,73 µg/l ont été mises en évidence après des erreurs de manipulation. Des concentrations urinaires de diquat inférieures à la limite de détection analytique (0,047 µg/l) ont été signalées chez des sujets exposés par voie cutanée à des concentrations de 0,17 à 1,82 µg/h, ou par inhalation à des concentrations inférieures à 0,01 µg/h. Pour les dosages, il est recommandé d’utiliser un échantillon des urines de 24 heures recueillies en fin d’exposition. A défaut, on pourra se servir d’un échantillon prélevé ponctuellement en fin de poste.
Le dosage sérique du paraquat est utile au pronostic en cas d’intoxication aiguë, la survie étant probable lorsque les taux sériques ne dépassent pas 0,1 µg/l, 24 heures après l’ingestion.
Summers (1980) a dressé la synthèse des méthodes analytiques convenant au dosage du paraquat et du diquat.
Le 4,6-dinitro-o-crésol (DNOC). Le DNOC est un herbicide qui a fait son apparition en 1925, mais dont l’utilisation a progressivement diminué en raison de sa forte toxicité pour les plantes et pour l’humain. Etant donné que les concentrations sanguines de DNOC présentent une certaine corrélation avec la sévérité des effets nocifs, le dosage sanguin du DNOC inchangé a été proposé pour surveiller les expositions professionnelles et évaluer l’état clinique des sujets intoxiqués.
Le pentachlorophénol. Le pentachlorophénol (PCP) est un biocide à large spectre actif sur les plantes adventices, les insectes et les champignons. Les dosages sanguins et urinaires du PCP inchangé sont recommandés comme indicateurs de surveillance des expositions professionnelles (Colosio et coll., 1993), car ils renseignent bien sur la charge corporelle en PCP. Chez les travailleurs exposés de façon prolongée au PCP, le moment des prélèvements sanguins n’est pas critique, alors que les échantillons ponctuels d’urine devraient être recueillis le matin suivant la fin de l’exposition.
Une méthode universelle applicable au dosage des métabolites des pesticides halogénés et nitrophénoliques a été décrite par Shafik et coll. (1973b).
D’autres tests proposés pour la surveillance biologique de l’exposition aux pesticides sont présentés dans le tableau 27.16.
|
Produits |
Indices biologiques |
|
|
|
Urine |
Sang |
|
Bromophos |
Bromophos |
Bromophos |
|
Captane |
Tétrahydrophtalimide |
|
|
Carbofurane |
3-Hydroxycarbofurane |
|
|
Chlorodiméforme |
Dérivés de la 4-Chloro-o-toluidine |
|
|
Chlorobenzilate |
p,p-1-Dichlorobenzophénone |
|
|
Dichloropropène |
Métabolites de l’acide mercapturique |
|
|
Fenitrothion |
p-Nitrocrésol |
|
|
Ferbame |
|
Thiurame |
|
Fluazifop-Butyl |
Fluazifop |
|
|
Flufenoxuron |
|
Flufenoxuron |
|
Glyphosate |
Glyphosate |
|
|
Malathion |
Malathion |
Malathion |
|
Produits organostanneux |
Etain |
Etain |
|
Trifenomorph |
Morpholine, triphénylcarbinol |
|
|
Zirame |
|
Thiurame |
Les indicateurs biologiques permettant de surveiller l’exposition aux pesticides ont été utilisés dans de nombreux travaux expérimentaux et dans des études de terrain.
Certains tests pour lesquels des limites biologiques d’exposition ont été proposées (voir tableau 27.17) sont validés par une longue expérience. Il en est ainsi du dosage des cholinestérases dans le sang ou du dosage sanguin ou urinaire de certains pesticides sous forme inchangée. D’autres tests, notamment ceux qui portent sur les métabolites sanguins ou urinaires, restent d’un emploi beaucoup plus limité en raison des problèmes analytiques ou des difficultés d’interprétation des résultats qi’ils posent.
|
Produits |
Indices biologiques |
BEI1 |
BAT2 |
HBBL3 |
BLV4 |
|
Inhibiteurs de l’AChE |
AChE dans le sang |
70% |
70% |
70%, |
|
|
DNOC |
DNOC dans le sang |
|
|
20 mg/l, |
|
|
Lindane |
Lindane dans le sang |
|
0,02mg/l |
0,02mg/l |
|
|
Parathion |
PNP urinaire |
0,5mg/l |
0,5 mg/l |
|
|
|
Pentachlorophénol (PCP) |
PCP urinaire |
2 mg/l |
0,3 mg/l |
|
|
|
Dieldrine/Aldrine |
Dieldrine dans le sang |
|
|
|
100 µg/l |
|
Endrine |
Anti-12-hydroxy-endrine urinaire |
|
|
|
130 µg/l |
|
DDT |
DDT et DDE sériques |
|
|
|
250 µg/l |
|
Coumarines |
Temps de Quick |
|
|
|
10% au-dessus de la valeur basale |
|
MCPA |
MCPA urinaire |
|
|
|
0,5 µg/l |
|
2,4-D |
2,4-D urinaire |
|
|
|
0,5 µg/l |
1 BEI = indices biologiques d’exposition recommandés par l’ACGIH (1995). 2 BAT = limites de tolérance biologique recommandées par la DFG (Commission allemande de recherche sur les risques liés aux composés chimiques utilisés sur les lieux de travail) (1992). 3 HBBL = limites biologiques recommandées par un Groupe de travail de l’OMS (1982b). 4 BLV = limites biologiques proposées par un Groupe de travail du Comité scientifique sur les pesticides de la Commission internationale de la santé au travail (Tordoir et coll., 1994). En cas de dépassement, une évaluation des conditions de travail est exigée.
La surveillance biologique est un domaine en pleine évolution. Vu l’importance que les indicateurs biologiques revêtent aux fins de la surveillance de l’exposition aux pesticides, le développement et la validation de nouveaux tests sont promis à une évolution constante.