

Le système lymphohématopoïétique comprend le sang, la moelle osseuse, la rate, le thymus, ainsi que les vaisseaux et les ganglions lymphatiques. Le sang et la moelle osseuse forment ensemble le système hématopoïétique. Site de la production cellulaire, la moelle osseuse renouvelle continuellement les éléments cellulaires du sang (érythrocytes, granulocytes et plaquettes). La production est étroitement contrôlée par un groupe de facteurs de croissance. Lorsque les granulocytes et les plaquettes assurent leurs fonctions physiologiques, ils sont détruits, tandis que les érythrocytes en vieillissant deviennent inutiles. Pour avoir une fonction efficace, les éléments cellulaires du sang doivent circuler en nombre suffisant et conserver à la fois leur intégrité structurale et physiologique. Les érythrocytes contiennent de l’hémoglobine qui permet la fixation et le transport d’oxygène dans les tissus, afin d’entretenir le métabolisme cellulaire. Les érythrocytes ont une durée de vie active normale de 120 jours. Les granulocytes transitent dans le sang, puis vers les tissus pour participer à la réaction inflammatoire contre les microbes ou d’autres agents. Les plaquettes circulantes jouent un rôle clé dans l’hémostase.
La production que doit assurer la moelle osseuse est prodigieuse. Chaque jour, elle remplace 3 milliards d’érythrocytes par kilogramme de poids corporel. Dans la circulation, les granulocytes ont une demi-vie de six heures seulement et 1,6 milliard de granulocytes doivent être produits quotidiennement par kilogramme de poids corporel. La population de plaquettes doit être entièrement renouvelée tous les 9,9 jours. Comme elle doit produire des quantités importantes de cellules fonctionnelles, la moelle est particulièrement sensible à toutes les atteintes infectieuses, chimiques, métaboliques ou environnementales qui affectent la synthèse de l’ADN ou perturbent les processus intracellulaires vitaux des hématies, des leucocytes ou des plaquettes. De plus, comme les cellules sanguines sont d’origine médullaire, le sang périphérique est le reflet sensible et précis de l’activité médullaire. Il est facile de faire une prise de sang par ponction veineuse et une analyse de sang permet de détecter de façon précoce une maladie induite par l’environnement.
Le système hématologique peut être considéré comme conducteur pour les substances qui pénètrent dans le corps et comme organe pouvant être affecté par des expositions professionnelles à des agents potentiellement nocifs. Les prélèvements sanguins peuvent servir de contrôle biologique de l’exposition et fournir le moyen d’évaluer les effets d’une exposition professionnelle sur le système lymphohématopoïétique et les autres organes.
Les agents présents dans l’environnement peuvent interférer de plusieurs manières avec le système hématopoïétique: en inhibant la synthèse d’hémoglobine, ainsi que la production ou la fonction cellulaire, et en provoquant des leucémies ou en accélérant la destruction des hématies.
On peut classer les anomalies de la numération ou de la fonction des cellules sanguines causées directement par les risques professionnels en deux groupes: 1) celles pour lesquelles le problème de santé est avant tout hématologique, comme l’anémie aplasique induite par le benzène; 2) celles pour lesquelles les effets sur le sang sont directs, mais moins importants, par rapport aux effets sur d’autres organes, comme l’anémie due au plomb. Les troubles hématologiques sont parfois un effet secondaire d’un risque professionnel. Ainsi, la polycythémie secondaire peut provenir d’une maladie pulmonaire professionnelle. Le tableau 1.1 donne la liste des risques qui sont généralement reconnus comme ayant un effet direct sur le système hématologique.
|
|
C’est à la fin du XIXe siècle que le benzène a été identifié comme toxique professionnel provoquant l’anémie aplasique (Goldstein, 1988). On a de bonnes raisons de penser que ce n’est pas le benzène lui-même, mais plutôt un ou plusieurs de ses métabolites qui sont responsables de sa toxicité hématologique, bien que l’on ne sache pas encore exactement quels sont ces métabolites et leurs cibles intracellulaires (Snyder, Witz et Goldstein, 1993).
En reconnaissant que le métabolisme du benzène joue un rôle dans sa toxicité, on admet implicitement — et les recherches récentes sur les processus participant au métabolisme de composés tels que le benzène le confirment — qu’il existe selon toute vraisemblance des variations dans la sensibilité au benzène d’un individu à l’autre, qui sont dues à des différences dans la cinétique du métabolisme, elles-mêmes conditionnées par des facteurs environnementaux ou génétiques. Il semble que des facteurs héréditaires prédisposent à l’anémie aplasique due au benzène, mais aucune preuve claire n’a été apportée. Le cytochrome P-450(2E1) paraît jouer un rôle important dans la formation de métabolites hématotoxiques du benzène, et des études menées récemment en Chine donnent à penser que les travailleurs chez qui ce cytochrome a une activité plus élevée présentent un risque accru. De même, il a été suggéré que la thalassémie mineure et probablement d’autres troubles avec accroissement de la régénération médullaire peuvent prédisposer une personne à l’anémie aplasique induite par le benzène (Yin et coll., 1996). Bien que l’on ait la preuve de certaines différences de sensibilité au benzène, il ressort de façon générale des travaux publiés que, contrairement à bon nombre d’agents, tels que le chloramphénicol, qui ont une gamme de sensibilité très large, et dont des expositions à des doses relativement peu élevées peuvent provoquer une anémie aplasique, la réaction à l’exposition au benzène est presque universelle. L’exposition au benzène est toxique pour la moelle osseuse et elle provoque une anémie aplasique dose-dépendante.
L’effet du benzène sur la moelle osseuse est donc analogue à celui des agents chimiothérapeutiques alkylants utilisés dans le traitement de la maladie de Hodgkin et d’autres cancers (Tucker et coll., 1988). A plus forte dose, on observe la baisse progressive de tous les éléments du sang qui se manifeste parfois au début sous forme d’anémie, de leucopénie ou de thrombocytopénie. Il convient de noter qu’il serait très surprenant d’observer chez un sujet une thrombocytopénie qui ne s’accompagnerait pas d’une baisse des autres éléments sanguins. De plus, une cytopénie isolée de ce type ne serait probablement pas grave. En d’autres termes, une numération leucocytaire isolée de 2 000 par µl, alors que le taux normal va de 5 000 à 10 000 par µl, suggérerait fortement que la leucopénie n’est pas due au benzène (Goldstein, 1988).
La moelle osseuse a une capacité de réserve importante. Après un degré même élevé d’hypoplasie de la moelle osseuse postchimiothérapie, l’hémogramme redevient généralement normal. Toutefois, les personnes qui ont subi ce type de traitement ne peuvent pas, lorsque leur moelle osseuse est attaquée par une endotoxine, par exemple, réagir en produisant une formule leucocytaire aussi élevée que les personnes qui n’ont jamais reçu de chimiothérapie. Il est raisonnable de supposer qu’à certaines doses, un agent tel que le benzène peut détruire les cellules précurseurs de la moelle osseuse et ainsi affecter sa capacité de réserve sans provoquer de lésions suffisamment importantes pour faire tomber la numération globulaire à un niveau inférieur à la fourchette normale des analyses de laboratoire. Une surveillance médicale de routine peut ne pas révéler d’anomalies chez un travailleur qui a pu en réalité souffrir d’une exposition; c’est pourquoi la protection des travailleurs doit faire porter ses efforts sur la prévention et appliquer des principes élémentaires d’hygiène du travail. Bien que l’on ne sache pas très bien dans quelle mesure le développement de la toxicité de la moelle osseuse est lié à l’exposition au benzène sur le lieu de travail, il ne semble pas qu’une exposition aiguë unique au benzène soit susceptible de provoquer une anémie aplasique. S’il en est ainsi, c’est que les cellules précurseurs de la moelle osseuse sont sensibles pendant certaines phases de leur cycle cellulaire seulement, peut-être au moment de leur division, et que toutes les cellules ne se trouvent pas dans cette phase pendant un tel type d’exposition. La rapidité avec laquelle se développe la cytopénie dépend en partie de la durée de vie du type cellulaire dans la circulation. La cessation complète de production de moelle osseuse devrait entraîner d’abord une leucopénie, parce que les leucocytes, en particulier les granulocytes, restent en circulation moins d’une journée. Ensuite, on devrait observer une diminution des plaquettes, dont la durée de survie est d’environ dix jours et, enfin, une diminution des hématies, qui ont une durée de vie de 120 jours.
Le benzène ne détruit pas seulement la cellule-souche pluripotentielle, qui est responsable de la production des hématies, des plaquettes et des granulocytes, mais il provoque également une diminution rapide des lymphocytes circulants aussi bien chez les animaux de laboratoire que chez l’humain. Il est donc possible que le benzène affecte le système immunitaire des travailleurs exposés, mais cet effet n’a pas encore été clairement prouvé (Rothman et coll., 1996).
L’exposition au benzène a été associée à l’anémie aplasique, qui est souvent mortelle. La cause du décès est généralement soit infectieuse, parce que la leucopénie compromet le système de défense de l’organisme, soit hémorragique, à cause de la thrombocytopénie. Un travailleur exposé au benzène qui développe une anémie aplasique grave doit être considéré comme une sentinelle des effets similaires chez ses collègues. Les études menées à partir de la découverte d’un individu sentinelle ont souvent mis en évidence des groupes de travailleurs présentant des signes évidents d’hématotoxicité au benzène. Pour la plupart, les personnes qui ne succombent pas très rapidement d’anémie aplasique guérissent généralement après cessation de l’exposition. Dans une étude de suivi d’un groupe de travailleurs ayant auparavant développé une pancytopénie importante induite par le benzène, seules quelques anomalies hématologiques résiduelles mineures ont été observées dix ans plus tard (Hernberg et coll., 1966). Néanmoins, quelques travailleurs de ces groupes, atteints initialement d’une pancytopénie relativement grave, ont développé tout d’abord une anémie aplasique, puis une phase préleucémique myélodysplasique et, enfin, une leucémie myéloïde aiguë (Laskin et Goldstein, 1977). Une telle évolution de la maladie n’est pas surprenante, puisque les personnes atteintes d’anémie aplasique, quelle qu’en soit la cause, présentent une probabilité plus grande que prévu de développer une leucémie myéloïde aiguë (de Planque et coll., 1988).
D’autres agents présents sur le lieu de travail ont été associés à l’anémie aplasique et, notamment, les rayonnements. Les effets des rayonnements sur les cellules-souches de moelle osseuse ont été utilisés dans la thérapie de la leucémie. De même, un grand nombre d’agents chimiothérapeutiques alkylants provoquent une aplasie et constituent de ce fait un risque pour les travailleurs chargés de produire ou d’administrer ces composés. Les rayonnements, le benzène et les alkylants semblent tous avoir un seuil au-dessous duquel l’anémie aplasique n’apparaît pas.
La protection des travailleurs affectés à la production devient plus problématique lorsque l’agent a un mode d’action idiosyncratique où des quantités infimes peuvent produire l’aplasie, comme c’est le cas pour le chloramphénicol. Le trinitrotoluène, facilement absorbé par la peau, a été associé à l’anémie aplasique dans les usines de munitions. Un grand nombre d’autres produits chimiques ont été reliés à l’anémie aplasique, mais il est souvent difficile d’établir un lien de cause à effet. Ainsi, des cas ont été décrits où un pesticide, le lindane (gamma-hexachlorure de benzène), est associé à l’aplasie, en général à des niveaux d’exposition relativement élevés. Cette observation est loin d’être universelle chez l’humain, et on ne mentionne pas de toxicité de la moelle osseuse induite par le lindane chez les animaux de laboratoire traités avec des doses massives de cet agent. L’hypoplasie de la moelle osseuse a également été corrélée à l’exposition aux éthylèneglycoléthers, à différents pesticides, ainsi qu’à l’arsenic (Flemming et Timmeny, 1993).
Les leucémies représentent 3% de tous les cancers dans le monde (Linet, 1985). Il s’agit d’un groupe d’affections malignes des précurseurs des cellules du sang, classées selon le type de cellule d’origine, le degré de différenciation cellulaire et le comportement clinique et épidémiologique. Les quatre types courants sont la leucémie lymphoblastique aiguë (LLA), la leucémie lymphoïde chronique (LLC), la leucémie myéloïde aiguë (LMA) et la leucémie myéloïde chronique (LMC). D’évolution rapide, la LLA est la forme la plus courante chez l’enfant; elle prend naissance dans les leucocytes et les ganglions lymphatiques. La LLC atteint les lymphocytes de la moelle osseuse, évolue très lentement et frappe les sujets âgés. La LMA est la forme commune de leucémie aiguë chez l’adulte. Au nombre des formes rares de leucémie aiguë, on peut citer les leucémies monoblastiques aiguës, à basophiles, à éosinophiles, les leucémies plasmocytaires, les érythroleucémies et les leucémies à tricholeucocytes. Ces formes rares de leucémie aiguë sont parfois regroupées sous le nom de leucémies aiguës non lymphocytaires, car on pense aussi qu’elles sont issues d’une cellule-souche commune. La plupart des cas de LMC se caractérisent par une anomalie chromosomique spécifique, le chromosome Philadelphie. La leucémie myéloïde chronique évolue souvent en leucémie myéloïde aiguë. La transformation en leucémie myéloïde aiguë peut aussi survenir dans la maladie de Vaquez (polycythémie vraie) et la thrombocythémie essentielle, troubles néoplasiques avec élévation du nombre d’hématies ou de plaquettes, dans les myélofibroses et la dysplasie myéloïde. C’est pourquoi on regroupe ces maladies sous l’appellation de syndromes myéloprolifératifs.
Le tableau clinique varie selon le type de leucémie. La plupart des patients souffrent de fatigue et de malaises. Des anomalies de numération de la formule sanguine et la présence de cellules atypiques font évoquer une leucémie et nécessitent un examen de la moelle osseuse. L’anémie, la thrombocytopénie, la neutropénie, un nombre élevé de leucocytes et de blastes sont des signes typiques de leucémie aiguë.
Incidence: l’incidence annuelle globale des leucémies, ajustée en fonction de l’âge, varie entre 2 et 12 pour 100 000 chez l’homme et entre 1 et 11 pour 100 000 chez la femme, selon les populations. On trouve les chiffres les plus élevés dans les populations d’Amérique du Nord, d’Europe occidentale et d’Israël; les plus bas dans celles d’Afrique et d’Asie. L’incidence varie en fonction de l’âge et du type de leucémie. L’incidence de la leucémie augmente nettement avec l’âge et on observe également un pic dans l’enfance entre deux et quatre ans. Selon les sous-groupes de leucémie, les incidences avec l’âge varient. La leucémie lymphoïde chronique est environ deux fois plus fréquente chez l’homme que chez la femme. Les chiffres de l’incidence et de la mortalité des leucémies chez l’adulte sont restés relativement stables au cours des dernières décennies.
Facteurs de risque: on a évoqué des facteurs familiaux dans l’apparition de la leucémie, mais les preuves ne sont pas concluantes. Certaines anomalies immunologiques, dont quelques-unes sont héréditaires, semblent effectivement prédisposer à cette maladie. Le mongolisme est un facteur de risque de leucémie aiguë. Deux rétrovirus oncogènes (virus de type 1 de la leucémie humaine à cellules T et virus de type 2 lymphotropique humain) ont été identifiés comme étant liés au développement de leucémies. On pense que ces virus sont des cancérogènes précoces et, à ce titre, ils ne peuvent pas être une cause suffisante de leucémie (Keating, Estey et Kantarjian, 1993).
Les rayonnements ionisants et l’exposition au benzène sont des causes établies de leucémies d’origine environnementale et professionnelle. L’incidence de la leucémie lymphoïde chronique n’a cependant pas été associée à l’exposition aux rayonnements. Un certain nombre de pays reconnaissent les leucémies causées par les rayonnements ou le benzène comme maladies professionnelles.
De façon beaucoup moins cohérente, des excès de leucémie ont été signalés pour les catégories professionnelles suivantes: chauffeurs; électriciens; monteurs et installateurs de lignes téléphoniques et ingénieurs en électronique; agriculteurs; minotiers; jardiniers; mécaniciens, soudeurs et métallurgistes; travailleurs du textile, de l’industrie papetière, du pétrole et de la distribution de produits pétroliers. Certains agents particuliers du milieu de travail ont été corrélés de manière constante à un risque accru de leucémie. Parmi eux, on peut citer le butadiène, les champs électromagnétiques, les gaz d’échappement, l’oxyde d’éthylène, les insecticides et les herbicides, les fluides d’usinage, les solvants organiques, les produits pétroliers (dont l’essence), le styrène et des virus non identifiés. L’exposition parentale à ces agents avant la conception a été mentionnée comme facteur d’augmentation du risque de leucémie chez le nouveau-né, mais, pour l’instant, les résultats ne sont pas suffisamment concluants.
Traitement et prévention: près de 75% des cas de leucémie masculine peuvent être prévenus (CIRC, 1990). La limitation de l’exposition aux rayonnements et au benzène réduit le risque de leucémie, mais la diminution qui pourrait en résulter dans le monde n’a pas été estimée. Les différents traitements des leucémies sont la chimiothérapie (produit unique ou combiné), la greffe de moelle osseuse et les interférons. La greffe de moelle osseuse dans les cas de leucémie lymphoblastique ou myéloïde aiguë permet une survie d’environ 25 à 60%. Le pronostic est mauvais pour les patients qui ne font pas de rémission ou qui rechutent. Parmi ceux qui rechutent, 30% environ ont une seconde rémission. La principale cause d’échec est le décès par infection ou hémorragie. Le taux de survie d’une leucémie aiguë non traitée est de 10% dans l’année qui suit le diagnostic. La durée moyenne de survie des patients atteints de leucémie lymphoïde chronique avant le début du traitement est de six ans. La durée de survie dépend du stade de la maladie au moment du diagnostic initial.
Les leucémies peuvent survenir à la suite d’un traitement médical tel que les rayonnements et certains agents chimiothérapeutiques dans le cadre d’une autre affection maligne, comme la maladie de Hodgkin, les lymphomes, les myélomes ou encore les cancers des ovaires et du sein. La plupart de ces cas secondaires de leucémie sont des leucémies aiguës non lymphocytaires ou un syndrome myélodysplasique, qui est un état préleucémique. Les anomalies chromosomiques semblent plus facilement observées dans les leucémies dues à des traitements et dans celles qui sont secondaires à une exposition aux rayonnements ou au benzène. Ces leucémies aiguës ont tendance à résister à la thérapie. On a signalé que l’activation de l’oncogène ras se produit plus fréquemment chez les patients atteints de leucémie myéloïde aiguë et travaillant dans des professions dont le risque d’exposition aux leucémogènes est élevé (Taylor et coll., 1992).
Les lymphomes malins constituent un groupe hétérogène de néoplasies affectant essentiellement les tissus et les organes lymphoïdes. Ils se divisent en deux grands types cellulaires: la maladie de Hodgkin (Classification internationale des maladies, CIM-9 201) et les lymphomes malins non hodgkiniens (CIM-9 200, 202). Les myélomes multiples (CIM-9 203) sont une affection maligne des plasmocytes à l’intérieur de la moelle osseuse qui représentent généralement moins de 1% de toutes les affections malignes (CIRC, 1993). En 1985, les lymphomes malins et les myélomes multiples occupaient la septième place de l’ensemble des cancers dans le monde. Ils représentaient 4,2% de tous les nouveaux cas de cancer estimés, soit au total 316 000 nouveaux cas (Parkin, Pisani et Ferlay, 1993).
Il ne semble pas exister d’associations constantes entre la mortalité, l’incidence de lymphomes malins et les catégories socio- économiques à l’échelle mondiale. La maladie de Hodgkin de l’enfant a tendance à être plus fréquente dans les pays moins développés, bien que l’on ait observé des taux relativement élevés chez les jeunes adultes dans des pays de régions plus développées. Dans certains pays, les lymphomes malins non hodgkiniens semblent en excès parmi les groupes socio-économiques les plus élevés, alors que dans d’autres, on n’a pas observé un tel gradient.
Les expositions professionnelles sont probablement un facteur de risque des lymphomes malins, mais les études épidémio-logiques n’ont pas permis de tirer de conclusions définitives. L’amiante, le benzène, les rayonnements ionisants, les solvants du type hydrocarbures chlorés, la poussière de bois et les produits chimiques entrant dans la fabrication du cuir et des pneumatiques sont des exemples d’agents associés au risque de lymphomes malins non spécifiés. Les lymphomes malins non hodgkiniens sont plus fréquents chez les agriculteurs. D’autres produits professionnels soupçonnés de provoquer la maladie de Hodgkin, des lymphomes malins non hodgkiniens et des myélomes multiples sont abordés plus loin dans ce chapitre.
La maladie de Hodgkin est un lymphome malin caractérisé par la présence de cellules géantes polynucléées (cellules de Reed-Sternberg). Les ganglions lymphatiques du médiastin et du cou sont touchés dans près de 90% des cas, mais la maladie peut également affecter d’autres sites. Les sous-types histologiques de cette pathologie diffèrent dans leur comportement clinique et épidémiologique. Le système de classification de Rye comprend quatre formes de maladie de Hodgkin: forme à prédominance lymphocytaire, forme scléronodulaire, forme à cellularité mixte et forme à déplétion lymphocytaire. La maladie de Hodgkin se diagnostique par biopsie de moelle osseuse et le traitement est la radiothérapie seule ou associée à la chimiothérapie.
Le pronostic des patients atteints de la maladie de Hodgkin dépend du stade de la maladie au moment du diagnostic. Ainsi, 85 à 100% de ceux qui sont sans atteinte médiastinale massive survivent environ huit ans à partir du début du traitement sans rechute. En cas d’atteinte médiastinale, il y a rechute dans près de 50% des cas. La radiothérapie et la chimiothérapie peuvent avoir différents effets secondaires, dont la leucémie secondaire myélocytaire aiguë mentionnée plus haut.
L’incidence de la maladie de Hodgkin n’a pas connu de grands changements avec le temps, à quelques exceptions près, comme dans les populations des pays nordiques, où les taux ont baissé (CIRC, 1993).
Les données disponibles montrent que, dans les années quatre-vingt, les populations du Costa Rica, du Danemark et de la Finlande avaient des taux annuels moyens d’incidence de la maladie de Hodgkin de 2,5 pour 100 000 chez les hommes et de 1,5 pour 100 000 chez les femmes (normalisés par rapport à la population mondiale), ce qui correspond à un indice de masculinité de 1,7. Chez les hommes, les taux les plus élevés ont été enregistrés aux Etats-Unis, en Irlande, en Italie et en Suisse et, chez les femmes, à Cuba et aux Etats-Unis. Des taux d’incidence peu élevés ont été déclarés au Japon et en Chine (CIRC, 1992).
On a pensé qu’une infection virale pouvait être impliquée dans l’étiologie de la maladie de Hodgkin. Ainsi, il a été démontré que la mononucléose infectieuse, qui est induite par le virus d’Epstein-Barr, virus de la famille herpès, est associée à un risque accru de maladie de Hodgkin. Celle-ci peut aussi revêtir un caractère familial et d’autres constellations de cas à caractère temporel et spatial ont été observées, mais les preuves de l’existence de facteurs étiologiques communs derrière ces séries de cas sont très faibles.
L’importance des facteurs professionnels sur les risques de maladie de Hodgkin n’a pas été établie. On peut citer trois agents suspects prédominants: les solvants organiques, les herbicides phénoxy et la poussière de bois, mais les arguments épidémiologiques sont limités et controversés.
Près de 98% des lymphomes malins non hodgkiniens sont des lymphomes lymphocytaires. Quatre classifications différentes au moins de lymphomes lymphocytaires ont été couramment utilisées (Longo et coll., 1993). De plus, une maladie maligne, le lymphome de Burkitt, est endémique dans certaines régions d’Afrique tropicale et de Nouvelle-Guinée.
Trente à 50% des lymphomes malins non hodgkiniens peuvent être guéris par la chimiothérapie ou la radiothérapie, voire par les deux en association. Il est parfois nécessaire de pratiquer une greffe de moelle osseuse.
Incidence: des taux annuels moyens d’incidences élevées de ce type de lymphome (plus de 12 pour 100 000, normalisés par rapport à la population mondiale) ont été signalés dans les années quatre-vingt parmi la population blanche des Etats-Unis, en particulier à New York et à San Francisco, ainsi que dans certains cantons suisses, au Canada, à Trieste (Italie) et chez les hommes à Porto Alegre (Brésil). L’incidence du lymphome malin non hodgkinien est généralement plus élevée chez les hommes que chez les femmes: de 50 à 100%. A Cuba, et dans la population blanche des Bermudes, elle est en revanche légèrement supérieure chez les femmes (CIRC, 1992).
Dans un certain nombre de pays, l’incidence et les taux de mortalité du lymphome malin non hodgkinien ont augmenté (CIRC, 1993). Jusqu’en 1988, l’incidence annuelle moyenne chez les hommes de race blanche aux Etats-Unis a augmenté de 152%. Cette augmentation est due à la fois au changement des pratiques de diagnostic des médecins et à l’augmentation des maladies immunosuppressives induites par le virus de l’immunodéficience humaine (VIH, associé au sida), par d’autres virus et par la chimiothérapie immunosuppressive. Ces facteurs n’expliquent toutefois pas tout cet accroissement et une proportion considérable de l’augmentation résiduelle serait imputable aux habitudes alimentaires, aux expositions environnementales, telles que les colorants capillaires, voire à des tendances familiales, ainsi qu’à des facteurs rares (Hartge et Devesa, 1992).
On a pensé que des facteurs étiologiques professionnels pourraient jouer un rôle dans le développement des lymphomes malins non hodgkiniens. A l’heure actuelle, on estime que 10% de ces lymphomes sont liés à des expositions professionnelles aux Etats-Unis (Hartge et Devesa, 1992), mais ce pourcentage varie selon l’époque et le lieu. Les causes professionnelles ne sont pas bien établies. Des excès de risque ont été associés aux emplois dans les centrales électriques, dans l’agriculture, la manipulation des céréales, la métallurgie et le bois, le raffinage du pétrole, de même que chez les chimistes. Au nombre des expositions professionnelles associées à un risque accru de lymphome malin non hodgkinien, on peut citer l’oxyde d’éthylène, les chlorophénols, les engrais, les herbicides, les insecticides, les colorants capillaires, les solvants organiques et les rayonnements ionisants. Un certain nombre de corrélations positives ont été rapportées dans le cas d’expositions à des herbicides à l’acide phénoxyacétique (Morrison et coll., 1992). Certains des herbicides concernés étaient contaminés par la 2, 3, 7, 8-tétrachlorodibenzo-p-dioxine (TCDD). Les données épidémiologiques sur l’origine professionnelle de ce type de lymphome restent cependant limitées.
Les myélomes multiples affectent essentiellement les os (notamment le crâne), la moelle osseuse et les reins. Il s’agit d’une prolifération maligne des cellules dérivées des lymphocytes-B qui synthétisent et sécrètent les immunoglobulines. Le diagnostic se fait à l’aide de la radiologie, par recherche de la protéinurie de Bence-Jones spécifique du myélome multiple, par recherche de plasmocytes anormaux dans la moelle osseuse et par immunoélectrophorèse. Le myélome multiple est traité par greffe de moelle osseuse, par radiothérapie, chimiothérapie conventionnelle ou polychimiothérapie et par thérapie immunologique. Les patients en traitement pour cette affection survivent de 28 à 43 mois en moyenne (Ludwig et Kuhrer, 1994).
L’incidence des myélomes multiples augmente fortement avec l’âge. On a observé des taux d’incidence annuels élevés, normalisés par rapport à l’âge (5 à 10 pour 100 000 chez les hommes et 4 à 6 pour 100 000 chez les femmes) dans la population noire des Etats-Unis, à la Martinique et chez les Maoris de Nouvelle-Zélande. Un grand nombre de populations chinoises, indiennes, japonaises et philippines ont des taux faibles (moins de 10 pour 100 000 chez les hommes et moins de 0,3 pour 100 000 chez les femmes) (CIRC, 1992). Le taux de myélomes multiples a augmenté en Asie, en Europe, en Océanie, ainsi que dans la population noire et blanche des Etats-Unis depuis les années soixante, mais cette augmentation a tendance à se stabiliser dans un certain nombre de populations européennes (CIRC, 1993).
A l’échelle mondiale, on constate un excès pratiquement constant de cette pathologie chez les hommes. Cet excès est de l’ordre de 30 à 80%.
On a signalé des séries de cas de myélomes multiples à caractère familial ou autre, mais aucune conclusion n’a pu être tirée quant à la cause de ces accumulations de cas. Aux Etats-Unis, le fait que l’incidence soit plus élevée dans la population noire que dans la population blanche semble indiquer qu’il pourrait y avoir, d’un groupe de population à l’autre, une différence de sensibilité d’hôte à caractère génétique. Des troubles immunologiques chroniques ont parfois été associés au risque de myélomes multiples. Les informations relatives à la distribution de cette maladie dans les classes sociales sont limitées et elles ne permettent pas de tirer de conclusions sur aucun gradient, quel qu’il soit.
Facteurs professionnels: des données épidémiologiques montrent un risque élevé de cette pathologie chez les travailleurs exposés à l’essence et ceux des raffineries, ce qui suggère une étiologie liée au benzène (Infante, 1993). On a observé de façon répétée des excès de cas de myélomes multiples chez les agriculteurs et les travailleurs agricoles. Les pesticides représentent un groupe d’agents suspects. Le pouvoir cancérogène des herbicides à l’acide phénoxyacétique n’est cependant pas suffisamment établi (Morrison et coll., 1992). Les dioxines sont en effet parfois présentes sous forme d’impuretés dans certains de ces herbicides. Un excès significatif de myélomes multiples a été rapporté chez les femmes résidant dans une zone contaminée à la 2, 3, 7, 8-tétrachlorodibenzo-p-dioxine (TCDD) après la catastrophe de Seveso, en Italie (Bertazzi et coll., 1993). Les résultats de l’étude de Seveso étant fondés sur deux cas apparus en dix années de suivi, d’autres observations sont nécessaires pour confirmer cette association. Une autre explication possible du risque accru chez les agriculteurs et les ouvriers agricoles serait l’exposition à certains virus (Priester et Mason, 1974).
On a soupçonné d’autres professions et d’autres produits d’être associés à un risque augmenté de myélomes multiples (peintres, chauffeurs de camions, par exemple); amiante, gaz d’échappement, colorants capillaires, rayonnements, styrène, chlorure de vinyle et poussière de bois. Toutefois, les données sur ces professions et ces produits ne permettent pas de dégager de conclusions définitives.
Le globule rouge a pour fonction essentielle d’apporter de l’oxygène aux tissus et d’éliminer le dioxyde de carbone. La fixation de l’oxygène dans les poumons et sa libération en fonction des besoins au niveau des tissus dépendent d’une série parfaitement équilibrée de réactions physico-chimiques. Il en résulte une courbe de dissociation complexe qui sert, chez une personne en bon état général, à saturer au maximum le globule rouge en oxygène dans des conditions atmosphériques normales et à libérer cet oxygène dans les tissus en fonction du niveau d’oxygène, du pH et d’autres indicateurs de l’activité métabolique. La libération de l’oxygène dépend également de la vitesse d’écoulement des érythrocytes oxygénés, qui dépend elle-même de la viscosité et de l’intégrité vasculaire. Dans les limites d’un hématocrite normal (volume d’hématies concentrées), l’équilibre est tel que toute diminution de la numération globulaire est compensée par une diminution de la viscosité, ce qui permet d’améliorer le débit. Une chute de l’oxygénation n’entraîne pas de symptômes tant que l’hématocrite ne descend pas au-dessous de 30%; inversement, une élévation de l’hématocrite au-dessus du niveau normal, comme dans le cas de la polycythémie, peut réduire la libération d’oxygène, car l’augmentation de la viscosité diminue le débit sanguin. La carence en fer constitue une exception, avec des symptômes de faiblesse et de lassitude, essentiellement dus, dans un premier temps, au manque de fer plutôt qu’à une forme d’anémie associée à ce manque (Beutler, Larsh et Gurney, 1960).
Le monoxyde de carbone est un gaz commun qui peut avoir de graves effets, parfois mortels, sur la capacité de l’hémoglobine de transporter l’oxygène. Le monoxyde de carbone fait l’objet d’une rubrique détaillée dans la partie relative aux produits chimiques de la présente Encyclopédie.
Composés produisant de la méthémoglobine: la méthémoglobine est une autre forme d’hémoglobine qui est incapable d’apporter de l’oxygène aux tissus. Pour participer au transport de l’oxygène, l’atome de fer situé au centre de l’hème de l’hémoglobine doit être dans son état ferreux chimiquement réduit. Une certaine quantité du fer contenu dans l’hémoglobine est continuellement oxydée dans son état ferrique. Ainsi, environ 0,5% de l’hémoglobine totale du sang est de la méthémoglobine, forme chimiquement oxydée de l’hémoglobine incapable de transporter l’oxygène. Une enzyme NADH-dépendante, la méthémoglobine réductase, réduit le fer ferrique en hémoglobine ferreuse.
Un certain nombre de produits chimiques utilisés en milieu de travail peuvent induire des niveaux de méthémoglobine cliniquement significatifs: c’est le cas des industries utilisant des colorants à l’aniline. Les autres produits chimiques fréquemment cités comme cause de méthémoglobinémie sur le lieu de travail sont les nitrobenzènes, d’autres nitrates et nitrites organiques et inorganiques, les hydrazines et un grand nombre de quinones (Kiese, 1974). Certains de ces produits chimiques sont énumérés dans le tableau 1.1 et sont traités de façon plus approfondie dans la partie relative aux produits chimiques de la présente Encyclopédie. Cyanose, confusion et autres signes d’hypoxie font partie de la symptomatologie couramment associée à la méthémoglobinémie. Les personnes exposées de façon chronique à ces produits chimiques peuvent avoir les lèvres bleues lorsque leur niveau de méthémoglobine est de l’ordre de 10% ou plus. Elles peuvent aussi ne pas présenter d’autres effets visibles. En cas de méthémoglobinémie, le sang est d’une couleur brun chocolat caractéristique. Le traitement consiste à éviter une nouvelle exposition. Des symptômes importants peuvent être observés, généralement à des taux de méthémoglobine supérieurs à 40%. Une thérapie au bleu de méthylène ou à l’acide ascorbique peut accélérer la réduction du niveau de méthémoglobine. Les personnes ayant un déficit en glucose-6-phosphate déshydrogénase peuvent avoir une hémolyse accélérée avec un traitement au bleu de méthylène (voir plus loin les commentaires sur le déficit en glucose-6-phosphate déshydrogénase).
Certains troubles héréditaires entraînent une méthémoglobinémie persistante, due soit à la condition d’hétérozygote à une hémoglobine anormale, soit à la condition d’homozygote à un déficit en méthémoglobine réductase NADH-dépendante du globule rouge. Les personnes hétérozygotes pour ce déficit enzymatique mettront plus de temps pour réduire l’élévation du taux de méthémoglobine dû à l’exposition à des substances chimiques que les personnes ayant un niveau normal d’enzyme.
Outre le fait qu’ils oxydent l’atome de fer de l’hémoglobine, bon nombre des produits chimiques susceptibles de provoquer une méthémoglobinémie, ou leurs métabolites, agissent aussi comme agents oxydants relativement non spécifiques, qui peuvent, à dose élevée, provoquer une anémie hémolytique avec corps de Heinz. Ce type de processus se caractérise par une dénaturation oxydative de l’hémoglobine, qui forme des corps d’inclusion associés à la membrane des globules rouges, que l’on appelle corps de Heinz et que l’on peut mettre en évidence à l’aide de colorants spéciaux. La membrane du globule rouge peut aussi être endommagée par oxydation. Bien qu’ils puissent produire une hémolyse importante, les produits énumérés dans le tableau 1.1 agissent principalement en formant de la méthémoglobine, pigment qui peut être mortel, plutôt qu’en provoquant l’hémolyse, dont l’effet est généralement limité.
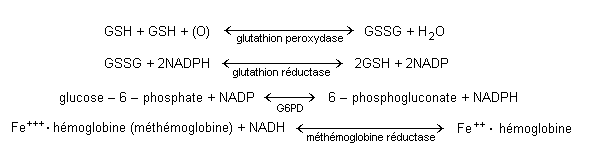
Il existe deux voies principales de défense du globule rouge: 1) la méthémoglobine réductase NADH-dépendante, qui est nécessaire pour réduire la méthémoglobine en hémoglobine normale; 2) la voie dérivée NADPH-dépendante des hexoses monophosphates (HMP) qui a pour rôle de maintenir le glutathion à l’état réduit comme moyen de défense contre les agents oxydants capables d’induire l’anémie hémolytique à corps de Heinz (voir figure 1.1). L’hémolyse des corps de Heinz peut être amplifiée par le traitement des patients méthémoglobinémiques au bleu de méthylène, car le NADPH est nécessaire à son activité de réduction de la méthémoglobine. L’hémolyse occupe une part importante du tableau clinique des sujets atteints 1) de déficiences d’une des enzymes des voies NADPH-dépendantes de défense de l’oxydation; ou 2) d’une hémoglobine instable héréditaire. A l’exception du déficit en glucose-6-phosphate déshydrogénase (G6PD), décrit plus loin dans ce chapitre, ce sont des troubles relativement rares.
Une autre forme d’altération de l’hémoglobine produite par des agents oxydants est une forme dénaturée connue sous le nom de sulfhémoglobine. Ce produit irréversible peut être détecté dans le sang de personnes ayant une méthémoglobinémie importante induite par des produits chimiques oxydants. On appelle également, de manière plus appropriée, sulfhémoglobine le produit spécifique formé au cours d’une intoxication par le sulfure d’hydrogène.
Agents hémolytiques: il existe un grand nombre d’agents hémolytiques sur le lieu de travail. Pour la plupart, c’est la méthémoglobinémie qui est l’action toxique à surveiller. Parmi ces agents hémolytiques, on peut citer le naphthalène et ses dérivés. De plus, certains métaux, tels que le cuivre et les composés organométalliques, comme le tributylétain, raccourcissent la survie des globules rouges, du moins dans les modèles animaux. Des hémolyses bénignes peuvent survenir après un effort physique traumatique (hémoglobinurie de la marche); plus récemment, on a observé une élévation du taux de leucocytes après un effort prolongé chez les personnes qui font de la course à pied (leucocytose du coureur). Le principal métal affectant la formation et la survie des globules rouges en milieu de travail est le plomb. Pour de plus amples renseignements sur cette substance, on se reportera à la partie relative aux produits chimiques de la présente Encyclopédie.
Arsine: les hématies normales ont une durée de vie de 120 jours. Une survie plus courte peut entraîner une anémie si elle n’est pas compensée par une augmentation de la production d’hématies par la moelle osseuse. Il existe essentiellement deux types d’hémolyse: 1) l’hémolyse intravasculaire, avec libération immédiate d’hémoglobine dans la circulation; 2) l’hémolyse extravasculaire où les hématies sont détruites dans la rate ou dans le foie.
Une des hémolysines intravasculaires les plus puissantes est le gaz arsine (AsH3). L’inhalation d’une quantité relativement faible de cet agent entraîne le gonflement, puis l’éclatement des globules rouges dans la circulation. Il peut s’avérer difficile de mettre en évidence la relation causale entre une exposition à l’arsine sur le lieu de travail et un épisode hémolytique aigu (Fowler et Wiessberg, 1974). En effet, il y a souvent un délai entre l’exposition à l’arsine et l’apparition des premiers symptômes et, de plus, la source d’exposition n’est souvent pas évidente. Le gaz arsine est fabriqué et utilisé commercialement, en particulier dans l’industrie électronique. Cependant, la plupart des cas d’hémolyse aiguë qui ont été publiés concernent la libération accidentelle de gaz arsine, comme sous-produit d’un procédé industriel, par exemple lors de l’ajout, dans une cuve en métal, d’acide contaminé par de l’arsenic. Tout procédé de réduction chimique de l’arsenic, comme l’acidification, peut entraîner la libération de gaz arsine. Comme l’arsenic peut être un contaminant de nombreux métaux et matières organiques, le charbon par exemple, l’exposition à l’arsine est bien souvent inattendue. La stibine, hydrure de l’antimoine, semble produire un effet hémolytique semblable à celui de l’arsine.
La mort peut survenir directement par déperdition complète des hématies (le cas d’un hématocrite de 0% a été décrit). Cependant, la préoccupation principale, dans le cas de niveaux d’arsine inférieurs à ceux qui produisent une hémolyse totale, est une atteinte rénale grave due à la libération massive d’hémoglobine dans la circulation. A des niveaux beaucoup plus élevés, l’arsine peut produire un œdème pulmonaire, voire des effets directs sur les reins. L’épisode aigu peut s’accompagner d’hypotension. On observe habituellement un délai de quelques heures au moins entre l’inhalation d’arsine et l’apparition des symptômes. Outre la présence d’urine rouge due à l’hémoglobinurie, le patient se plaint souvent de douleurs abdominales et de nausées, symptômes qui apparaissent en même temps que l’hémolyse intravasculaire aiguë (Neilsen, 1968).
Le traitement doit maintenir la perfusion rénale et transfuser du sang normal. Etant donné que les hématies circulantes affectées par l’arsine vont dans une certaine mesure provoquer une hémolyse intravasculaire, une exsanguino-transfusion semble la meilleure thérapie. Comme dans les cas d’hémorragie aiguë, il est important que le niveau d’acide 2, 3-diphosphoglycérique (DPG) des globules rouges transfusés soit suffisant, de manière à pouvoir libérer l’oxygène dans les tissus.
Un grand nombre de médicaments, tels que la propylthiourée (PTU), sont connus pour affecter de manière relativement sélective la production ou la survie des leucocytes polynucléaires circulants. En revanche, des toxiques médullaires non spécifiques affectent également les précurseurs des globules rouges et des plaquettes. Les travailleurs qui préparent ou administrent ces médicaments doivent être considérés comme étant à risque. On a signalé un cas de granulopénie totale chez un travailleur intoxiqué au dinitrophénol. L’altération du nombre et de la fonction des lymphocytes et, notamment, de la distribution des sous-types, retient de plus en plus l’attention en tant que mécanisme possible plus subtil des effets dus à de très nombreux produits chimiques sur le lieu de travail ou dans l’environnement en général, en particulier les hydrocarbures chlorés, les dioxines et les composés apparentés. Il est nécessaire de valider les études sur les implications que ces altérations des lymphocytes peuvent avoir sur la santé.
Comme pour la leucopénie, un grand nombre de médicaments diminuent de manière sélective la production ou la survie des plaquettes circulantes et peuvent, de ce fait, être à l’origine de problèmes chez les travailleurs chargés de les préparer ou de les administrer. Sinon, seuls quelques cas de thrombocytopénie ont été observés de façon ponctuelle chez des travailleurs. Une étude incrimine le diisocyanate de toluylène (TDI) comme cause de purpura thrombocytopénique. Les anomalies des différents facteurs sanguins impliqués dans la coagulation n’ont généralement pas une origine professionnelle. Les personnes atteintes d’anomalies préexistantes de la coagulation, comme l’hémophilie, ont souvent du mal à trouver un emploi. Cependant, à l’exclusion de certains postes bien précis qui doivent leur être interdits, ces personnes sont généralement capables d’exercer une activité professionnelle normale.
Comme il est relativement facile d’obtenir des échantillons, on est beaucoup mieux renseigné sur les variations héréditaires des composants du sang humain que sur celles de tout autre organe. Grâce aux nombreuses études qui ont été effectuées à la suite de la découverte d’anémies familiales, on a une bonne connaissance des implications structurelles et fonctionnelles des altérations génétiques. En milieu de travail, il existe des variations héréditaires susceptibles d’entraîner une sensibilité accrue aux risques professionnels. Le dépistage chez les travailleurs de certaines de ces variations a été envisagé ou est en fait déjà pratiqué. Avec la progression rapide des connaissances en génétique humaine, on comprendra certainement mieux le rôle que joue l’hérédité dans les différences de réaction chez l’humain et les tests de laboratoire permettront de prédire de manière plus sûre l’ampleur de la sensibilité individuelle.
Avant d’étudier la valeur potentielle des marqueurs de susceptibilité actuellement disponibles, il convient de souligner les principales questions d’éthique que pose l’utilisation de ces tests en milieu de travail. On s’est demandé s’ils n’auraient pas pour conséquence d’exclure des travailleurs de certains sites au lieu de chercher, dans leur intérêt, à améliorer le milieu de travail. Avant de décider d’employer ces marqueurs sur un lieu de travail, il faut — à tout le moins — que les objectifs des tests et les conséquences des conclusions que l’on peut en tirer soient clairs pour l’ensemble des parties.
Les deux marqueurs de susceptibilité hématologique qui font le plus souvent l’objet d’un dépistage sont le trait drépanocytaire et le déficit en G6PD. Le premier a une valeur plutôt secondaire dans de rares cas, alors que le second n’a aucune utilité dans la plupart des situations pour lesquelles il a été préconisé (Goldstein, Amoruso et Witz, 1985).
La drépanocytose, qui est un homozygotisme pour l’hémoglobine S (HbS), est un trouble assez commun chez les personnes d’origine africaine. Il s’agit d’une maladie relativement grave qui empêche souvent, mais pas toujours, l’entrée dans la vie active. Le gène HbS peut être acquis héréditairement avec d’autres gènes, comme le HbC, qui peuvent atténuer la gravité de ses effets. Le dysfonctionnement principal chez les personnes atteintes de drépanocytose est la polymérisation de l’HbS, qui entraîne un microinfarcissement. Ce micro-infarcissement peut se produire par épisodes, appelés crises drépanocytaires, et il peut être dû à des causes externes, en particulier les facteurs entraînant l’hypoxie et, dans une moindre mesure, la déshydratation. Chez les personnes atteintes de drépanocytose, l’évolution clinique est très variable et les crises sont relativement espacées: la décision d’aptitude à l’emploi devrait être prise sur la base des antécédents médicaux. Les métiers présentant une possibilité d’exposition hypoxique (des voyages aériens fréquents), ou ceux avec un risque de déshydratation importante, ne conviennent pas à ces sujets.
Le trait drépanocytaire, qui est le caractère hétérozygote avec un gène de l’HbS et un gène de l’HbA, est encore plus courant que la drépanocytose. Les personnes possédant ce caractère génétique sont sujettes à une crise drépanocytaire dans des conditions d’hypoxie extrêmes. On a songé à exclure ces personnes des lieux de travail où l’hypoxie est un risque courant: les emplois à bord des avions militaires et dans les sous-marins et, éventuellement, dans les avions de ligne. Il convient cependant de préciser que les personnes présentant un tel trait peuvent fort bien travailler dans presque tous les autres domaines. Ainsi, aucun effet secondaire n’a été observé chez les athlètes ayant un trait drépanocytaire qui ont participé aux épreuves sportives des Jeux olympiques d’été de 1968 à Mexico, ville pourtant située à 2 200 m d’altitude. A part les quelques exceptions que nous venons de mentionner, il ne se justifie donc pas d’envisager d’exclure ces personnes ou de modifier leur rythme de travail.
La forme A– de déficit en G6PD est une autre variante génétique courante d’un composant du globule rouge. Elle est héritée du chromosome X comme gène sexuel récessif et, dans la population noire des Etats-Unis, on la trouve environ chez un homme sur sept et chez une femme sur cinquante. En Afrique, ce gène est particulièrement prévalent dans les zones où le risque de paludisme est élevé. Comme dans le cas du trait drépanocytaire, le déficit en G6PD apporte une protection contre le paludisme. Dans des conditions normales, les personnes présentant cette forme de déficit en G6PD ont un hémogramme et des indices normaux. Toutefois, du fait de leur incapacité de régénérer le glutathion réduit, leurs globules rouges risquent l’hémolyse après ingestion de médicaments oxydants et dans certaines affections. A cause de cette sensibilité aux agents oxydants, le dépistage a été effectué en partant à tort du principe que les personnes présentant la variante A– du déficit en G6PD couraient un risque en inhalant des gaz oxydants. En fait, il faudrait une exposition à des doses largement supérieures à celles auxquelles ces gaz provoquent un œdème pulmonaire mortel pour que les globules rouges des personnes ayant un déficit en G6PD subissent un stress oxydatif suffisant pour être préoccupant (Goldstein, Amoruso et Witz, 1985). Le déficit en G6PD augmente la probabilité d’hémolyse déclarée des corps de Heinz chez les personnes exposées aux colorants à l’aniline et aux autres agents provoquant la méthémoglobine (voir tableau 1.1), mais dans ces cas, le problème clinique essentiel reste la méthémoglobinémie potentiellement mortelle. Si la connaissance de l’état du G6PD peut s’avérer utile dans ces cas précis, avant tout pour orienter la thérapie, elle ne saurait être utilisée pour exclure les travailleurs du lieu de travail.
Il existe de nombreuses autres formes de déficit familial en G6PD, qui sont toutes beaucoup moins communes que la variante A– (Beutler, 1990). Certaines de ces variantes, notamment chez les personnes du bassin méditerranéen et d’Asie centrale, comportent des niveaux d’activité de G6PD très inférieurs. Aussi, les sujets présentant ce déficit peuvent être sévèrement atteints par une anémie hémolytique prolongée. Des cas de déficiences d’autres enzymes de défense contre les agents oxydants ont été décrits. Dans ces déficiences, les hémoglobines sont instables, ce qui rend le globule rouge plus sensible au stress oxydant, comme dans le cas du déficit en G6PD.
Aussi bien pour l’évaluation des patients malades que pour le dépistage chez les individus apparemment sains, la surveillance doit être organisée de façon très différente par rapport au test clinique. Le but d’un programme de surveillance bien adapté est de prévenir la maladie en détectant précocement les petits changements par des tests de laboratoire. C’est pourquoi, en cas de résultats légèrement anormaux, le médecin devrait automati-quement réagir et, en tout cas, effectuer au moins un examen approfondi.
Lorsqu’on étudie pour la première fois les données de surveil-lance hématologique dans un groupe de travailleurs susceptibles d’être exposés à un produit hématotoxique tel que le benzène, on dispose essentiellement de deux méthodes pour mettre en évidence les sujets faussement positifs. Premièrement, le degré de différence par rapport à la normale. La probabilité qu’il s’agisse simplement d’une anomalie statistique décroît très rapidement avec l’écart de l’hémogramme par rapport à la normale. Deuxièmement, l’ensemble des informations concernant cette personne, y compris les valeurs normales, en pensant à toute la gamme des effets produits par le benzène. Ainsi, la probabilité d’un effet du benzène est plus grande si un nombre relativement faible de plaquettes s’accompagne d’une formule leucocytaire basse mais normale, d’un hémogramme normal-bas, et d’un volume globulaire moyen (VGM) normal-élevé. Inversement, cette même numération plaquettaire ne doit pas être attribuée à une hématotoxicité du benzène si les autres numérations sont à l’opposé du spectre normal. Ces deux considérations peuvent être utilisées pour décider de maintenir le travailleur à son poste en attendant les résultats d’autres analyses et demander d’autres tests, plutôt que de refaire une simple numération globulaire complète (NGC).
S’il y a un doute sur l’origine de la numération basse, la NGC doit être effectuée une nouvelle fois. Si cette faible valeur est seulement due à une variabilité du laboratoire d’analyses ou à une variabilité biologique ponctuelle, il est peu probable que l’on retrouve une numération globulaire basse. Une comparaison avec des numérations globulaires effectuées avant l’entrée en fonction, ou antérieurement, doit permettre d’établir si l’individu a une tendance propre à se situer à la limite inférieure de la distribution. Lorsqu’on constate qu’un travailleur présente des effets dus à un produit hématotoxique, il doit servir de sentinelle biologique et on doit effectuer une étude sérieuse sur les conditions de travail et sur ses collègues de travail (Goldstein, 1988).
La grande variabilité de la numération globulaire observée dans des conditions normales par le laboratoire d’analyses lance un défi encore plus grand, car on peut avoir affaire à des effets importants, même si la numération se situe dans une gamme normale. Ainsi, chez un travailleur exposé au benzène ou à des rayonnements ionisants, il peut arriver que l’hématocrite tombe de 50 à 40%, la formule leucocytaire de 10 000 à 5 000 par mm3 et le nombre de plaquettes de 350 000 à 150 000 par mm3 — soit une baisse de plus de 50% du nombre de plaquettes; pourtant, on reste dans des valeurs «normales» de numération cellulaire. Aussi, un programme de surveillance qui s’intéresse uniquement aux numérations globulaires «anormales» risque de passer à côté d’effets significatifs. C’est pourquoi il faut porter une attention toute particulière aux numérations globulaires qui diminuent progressivement tout en restant dans la fourchette normale.
Il est un autre défi, tout aussi difficile à relever en matière de surveillance au travail, celui qui consiste à détecter une légère diminution de la numération globulaire moyenne de la totalité d’une population exposée — par exemple, une baisse de la formule leucocytaire moyenne de 7 500 à 7 000 par mm3 consécutive à une exposition importante au benzène ou à des rayonnements ionisants. Pour pouvoir déceler et évaluer correctement ce type d’exposition, il faut s’assurer que les procédures de test en laboratoire sont parfaitement normalisées, qu’il existe un contrôle adéquat et qu’une analyse statistique soigneuse est bien effectuée.